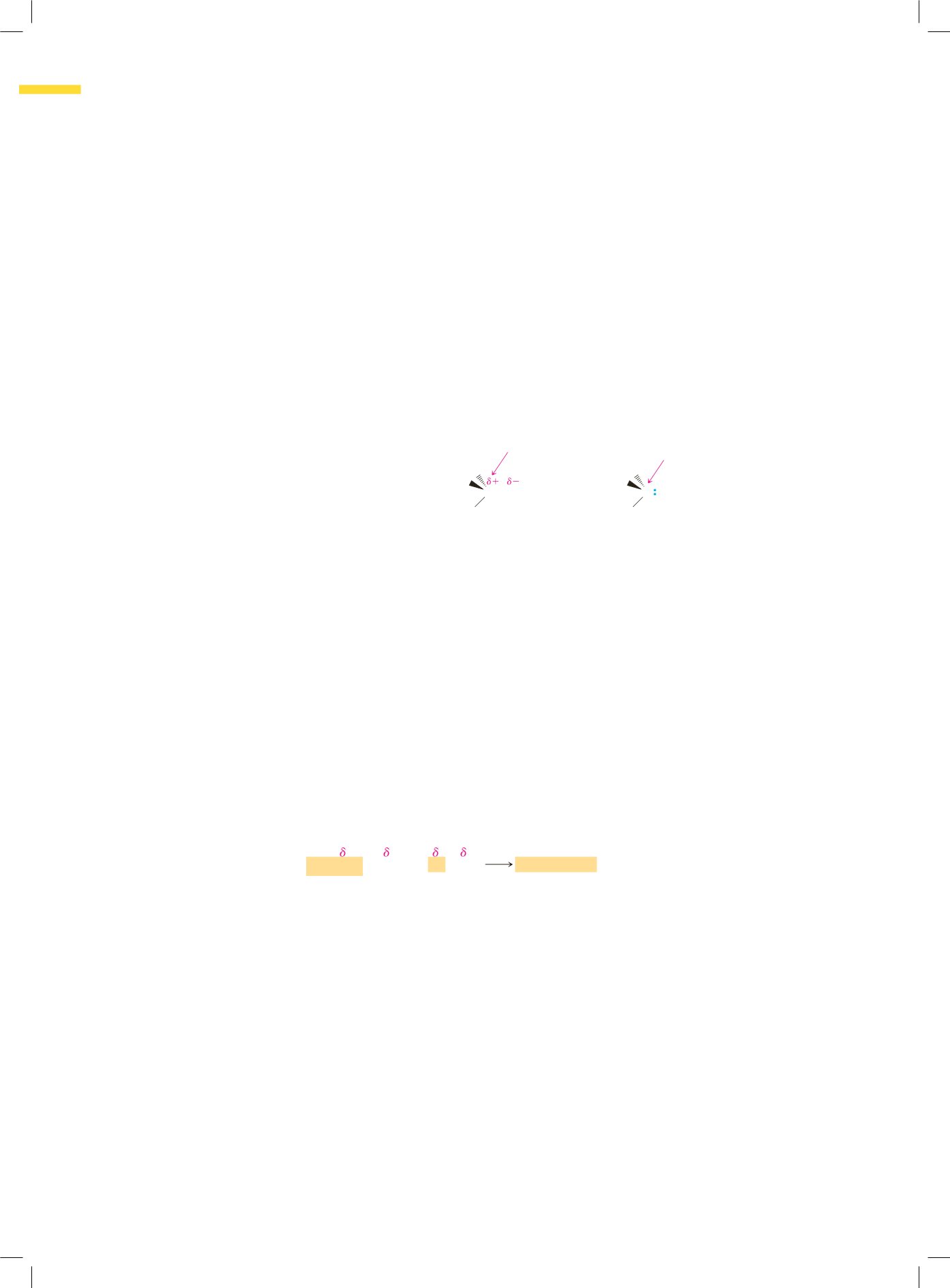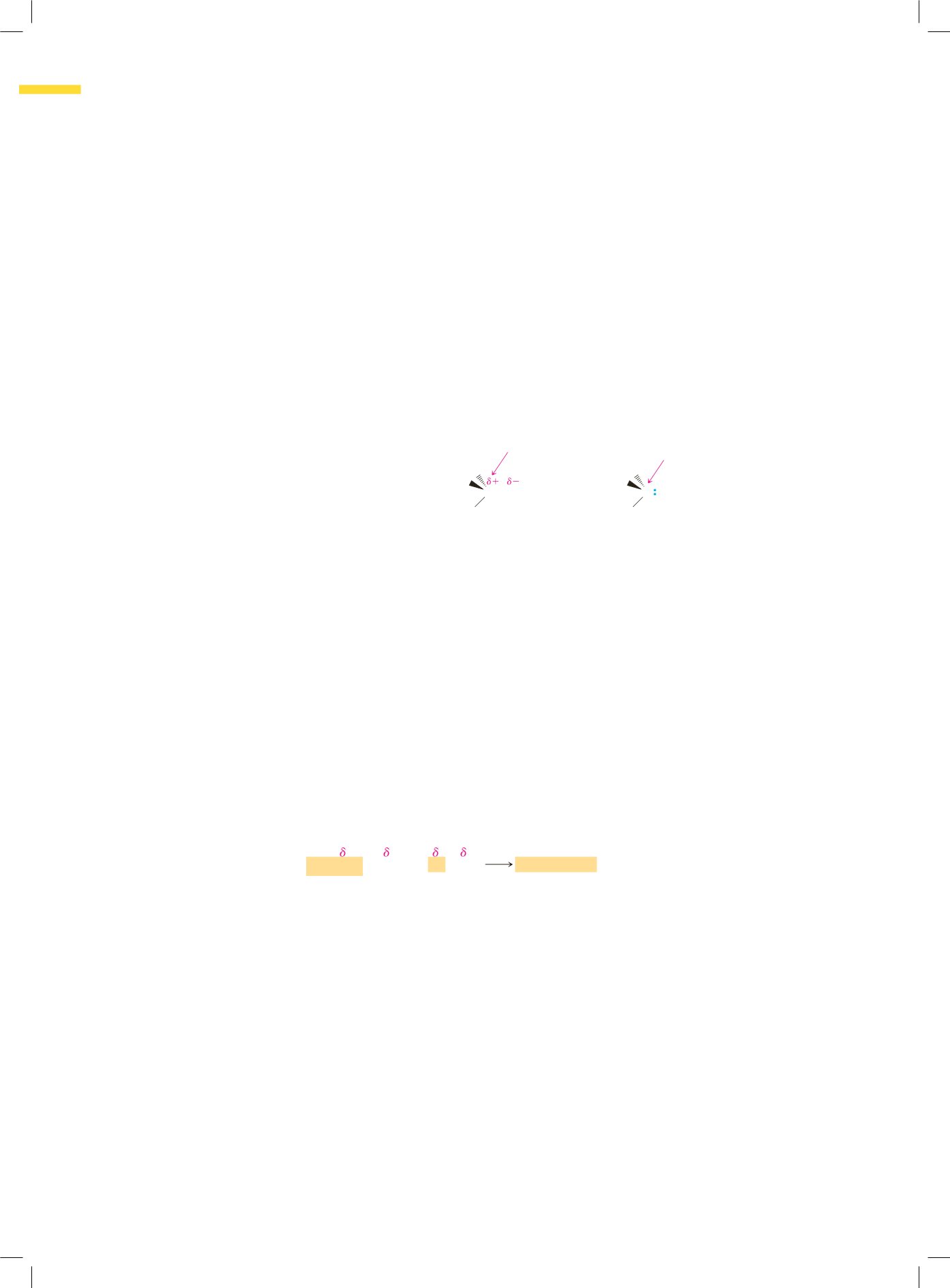
Capitolo 12
Un’introduzione
ai composti
organometallici
494
I legami
C
!
Li
e
C
!
Mg
hanno la più elevata percentuale di carattere ionico,
mentre la più bassa è quella dei composti organorameici ed organomercurici. Questi
composti non si comportano come sali. I reattivi organometallici del litio, ad esem-
pio, che possiedono la più alta percentuale di carattere ionico, si sciolgono in solventi
idrocarburici non polari, come il pentano, poiché sono in grado di organizzarsi come
aggregati
(RLi)
x
, con la conseguente formazione di una superficie non polare esposta
al solvente.
Una caratteristica importante dei metalli riportati in Tabella 12.1 è quella di pos-
sedere un’elettronegatività considerevolmente inferiore rispetto a quella del carbo-
nio; ciò significa che la polarità del legame carbonio-metallo determina una parziale
carica negativa sull’atomo di carbonio ed una parziale carica positiva su quello del
metallo. La presenza di una parziale carica negativa sull’atomo di carbonio gli confe-
risce caratteristiche sia basiche che nucleofile. Quando vengono preparati i reattivi di
Grignard e quelli del litio, l’atomo di carbonio che porta la funzione alogenata è tra-
sformato da centro elettrofilo (parziale carica positiva) nell’alogenoalcano, -alchene o
-arene, in un centro nucleofilo (parziale carica negativa) nel composto organometal-
lico. Nella formula di struttura del bromuro di butilmagnesio sulla destra, il legame
C
!
Mg
viene mostrato in forma ionica per enfatizzare il suo carattere nucleofilo.
–
CH
3
CH
2
CH
2
Il carbonio è
elettro lo
C
9
Br
H
H
CH
3
CH
2
CH
2
Il carbonio è
nucleo lo
C Mg
2
1
Br
–
H
H
Come nucleofili, questi composti reagiscono con l’atomo di carbonio elettrofilo
del gruppo carbonilico di aldeidi e chetoni (Capitolo 13), esteri degli acidi carbossilici
e cloruri acilici (Capitolo 15). In questo risiede l’importanza dei reattivi organome-
tallici del magnesio e del litio nella chimica organica di sintesi; infatti, come compo-
sti contenenti un carbonio nucleofilo, possono essere utilizzati per la formazione di
nuovi legami carbonio-carbonio.
B. Reazione con gli acidi protici
Sia i composti organometallici del magnesio che quelli del litio sono basi molto forti
e reagiscono rapidamente con qualsiasi acido (donatore di protoni) più forte dell’al-
cano dal quale derivano. Il bromuro di etilmagnesio, ad esempio, reagisce istantanea-
mente con l’acqua che, donando un protone, porta alla formazione di etano e del sale
di magnesio. Questa reazione è un esempio di un acido più forte e una base più forte
che reagiscono per dare un acido più debole e una base più debole (Paragrafo 4.4).
Dalla miscela di reazione si sviluppa etano come gas.
CH
3
CH
2
9
MgBr
Base
più forte
Base
più debole
CH
3
CH
2
9
H Mg
2
1
1
OH
2
1
Br
2
p
K
eq
5 2
35
K
eq
5
10
35
p
K
a
15.7
Acido
più forte
p
K
a
51
Acido
più debole
H
9
OH
1
1
1 2
21
Qui di seguito viene riportato un elenco di diverse classi di acidi (donatori di protoni)
che reagiscono facilmente con i reattivi di Grignard ed i composti organometallici del
litio. Poiché reattivi di Grignard e composti organometallici del litio reagiscono così
velocemente con questi tipi di composti, essi non possono essere preparati da alcun
organoalogenuro che contenga uno di questi gruppi funzionali; inoltre, non possono
essere preparati da un organoalogenuro che contenga un nitro-gruppo o un gruppo
carbonilico, con i quali sono in grado di reagire.
R
2
NH RC
#
CH ROH HOH ArOH RSH RCOOH
p
K
a
38-40
Ammine
1°
e
2°
p
K
a
25
Alchini
terminali
p
K
a
16-18
Alcoli
p
K
a
15.7
Acqua
p
K
a
9-10
Fenoli
p
K
a
8-9
Tioli
p
K
a
4-5
Acidi
carbossilici