
C C
N
R
H
H
H
O
O
–
Amminoacido (zwitterione)
pH normale
(7,35–7,45)
Aumento di acidità (diminuzione di pH)
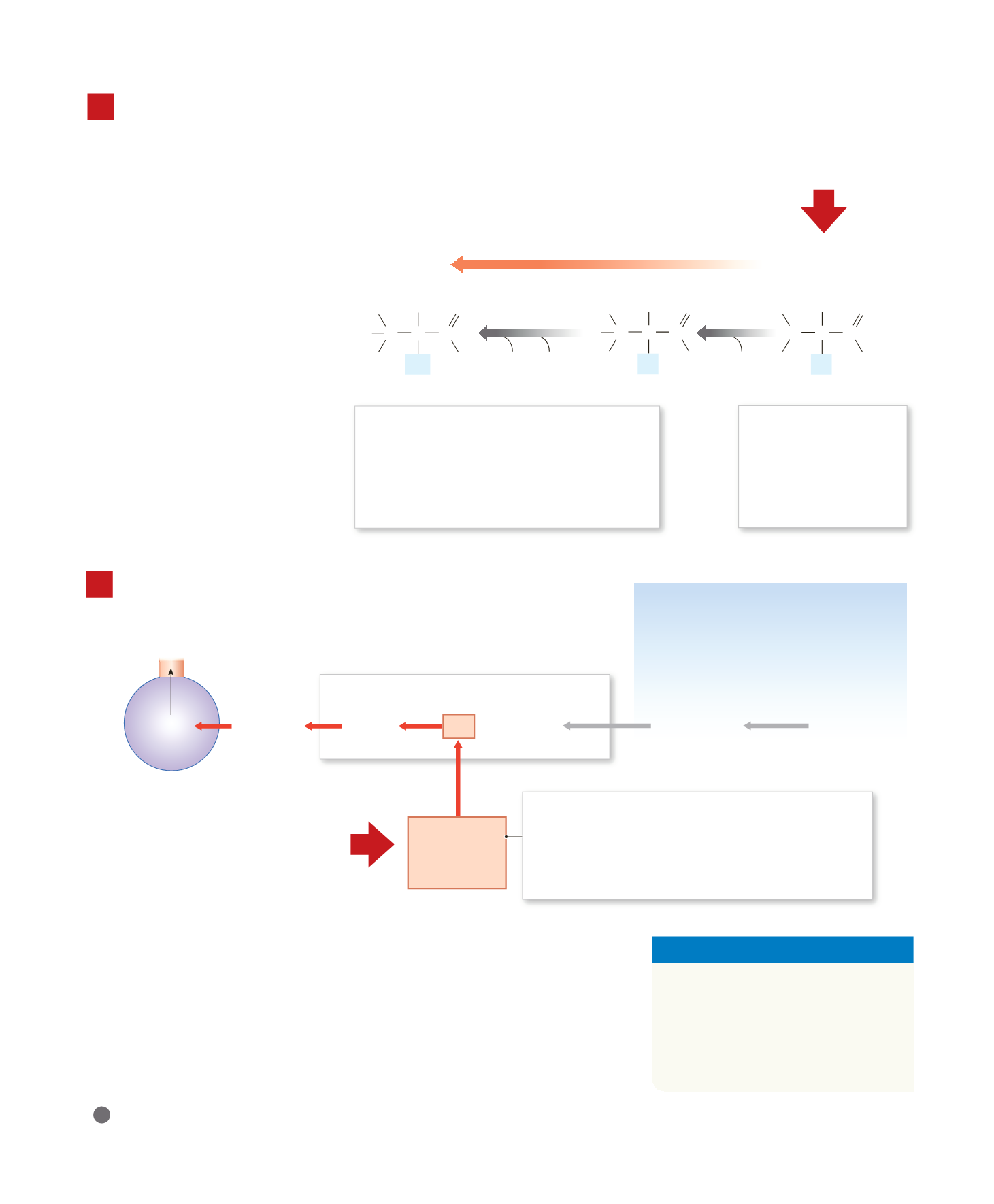
I liquidi corporei contengono una grande
riserva di HCO
3
–
, principalmente sotto forma
di molecole della base debole bicarbonato di
sodio (NaHCO
3
) in soluzione. Questa riserva
prontamente disponibile di HCO
3
–
è definita
riserva dei bicarbonati.
Aggiunta di H
+
prodotti
dall’attività
metabolica
Al pH normale dei liquidi
corporei (7,35–7,45), né i
gruppi carbossilato (COO
–
)
né i gruppi amminici
(–NH
2
) della maggior parte
degli amminoacidi sono
legati a ioni idrogeno.
Se il pH diminuisce, il gruppo carbossilato (COO
–
) e il
gruppo amminico (–NH
2
) di un amminoacido
possono fungere da basi deboli e accettare ioni
idrogeno aggiuntivi, formando rispettivamente un
gruppo carbossilico (–COOH) e uno ione ammino
(–NH
3
+
). Anche molti dei gruppi R possono
accettare ioni idrogeno, formando RH
+
.
La funzione principale del sistema tampone acido carboni-
co-bicarbonato è quella di protezione dagli effetti degli
acidi organici e fissi prodotti dal metabolismo. Infatti, esso
lega l’H
+
rilasciato da questi acidi e produce acido carboni-
co che si dissocia in acqua e anidride carbonica, che viene
facilmente eliminata attraverso i polmoni.
C C
N
R
O
–
H
H
H
O
C C
N
R
H
+
O
H
H
H
O
H
2
CO
3
H
+
SISTEMA TAMPONE ACIDO
CARBONICO-BICARBONATO
NaHCO
3
(bicarbonato di sodio)
+ Na
+
HCO
3
–
RISERVA DEI BICARBONATI
CO
2
+ H
2
O
CO
2
+ HCO
3
–
(acido carbonico)
(ione bicarbonato)
Polmoni
I sistemi tampone proteici impediscono cambiamenti
significativi del pH, di solito legando gli ioni idrogeno (H
+
)
in eccesso. Questi tamponi dipendono dalla capacità degli ammi-
noacidi di rispondere alle variazioni di pH, accettando o rilascian-
do H
+
. Ogni amminoacido ha un pH specifico (normalmente
inferiore a 7) in cui il gruppo carbossilico ha rilasciato uno ione
idrogeno e il gruppo amminico ne ha legato uno. Questa forma,
che non ha carica ionica netta, è chiamato
zwitterione
. Nelle solu-
zioni con pH superiore a 7, il gruppo amminico (NH
2
), il gruppo
carbossilato (COO
–
) e il gruppo
laterale (R) della maggior parte degli
amminoacidi liberi possono agire
come tampone. Il meccanismo impli-
cato è indicato qui. Tuttavia, in una
proteina, la maggior parte dei gruppi
carbossilato e amminici della catena
principale è impegnata in legami
peptidici. Solo il gruppo amminico e
il gruppo carbossilato situati alle due
estremità della catena proteica sono
disponibili per esplicare un’attività
tampone. Così, la maggior parte delle
capacità tampone delle proteine è
fornita dai gruppi R degli ammino-
acidi.
3
Il sistema tampone acido carbonico-bicarbonato coinvolge reazioni
liberamente reversibili. Un cambiamento nella concentrazione di
qualsiasi componente influenza le concentrazioni di tutti gli altri compo-
nenti e modifica la direzione delle reazioni in corso.
4
Squilibri acido-base metabolici
derivano dalla produzione o dalla perdita
di quantità eccessive di acidi fissi o organici. Il ruolo primario del sistema
tampone acido carbonico-bicarbonato è quello di proteggere da tali altera-
zioni.
Squilibri acido-base respiratori
derivano da uno squilibrio tra la
velocità di generazione di CO
2
e la velocità di eliminazione della CO
2
dai
polmoni. Il sistema tampone acido carbonico-bicarbonato non può proteg-
gere dalle patologie respiratorie; gli squilibri devono essere corretti da cam-
biamenti nella profondità e nella frequenza del respiro.
Inizio
Inizio
H
+
H
+
H
+
H
+
+
H
H
Sezione 2: Equilibrio acido-base
•
a.
Identificare i tre principali sistemi
tampone del corpo.
b.
Quali liquidi sono tamponati dal
sistema del tampone fosfato?
c.
Descrivere il sistema tampone acido
carbonico-bicarbonato.
Verifica del modulo .
OA
.
Spiegare il ruolo dei sistemi tampone nel regolare il
pH dei liquidi intracellulare ed extracellulare.
















