
Quando i livelli di anidride carbonica aumentano, si forma più
acido carbonico e vengono rilasciati ulteriori ioni idrogeno e
bicarbonato e il pH diminuisce.
Quando la P
CO
2
diminuisce, la reazione avviene al contrario e
l’acido carbonico si dissocia in anidride carbonica e acqua.
Di conseguenza, ioni idrogeno vengono rimossi dalla
soluzione e il pH aumenta.
40–45
mm Hg
7,35–7,45
OMEOSTASI
P
CO
2
pH
P
CO
2
pH
Se la P
CO
2
aumenta
Se la P
CO
2
diminuisce
pH
P
CO
2
H
2
CO
3
H
2
O + CO
2
H
+
+ HCO
3
–
H
2
CO
3
H
2
O + CO
2
H
+
+ HCO
3
–
HY
H
+
+
Y
–
+
HY
H
+
+
Y
–
H
+
H
+
H
+
+
Y
–
+
HY
H
+
H
+
La pressione parziale di anidride carbonica (P
CO
2
) nel sangue è il fattore
più importante capace di alterare il pH dei tessuti corporei, in quanto
l’anidride carbonica si combina con l’acqua per formare
acido carbonico
(H
2
CO
3
). Poiché la maggior parte dell’anidride carbonica in soluzione viene
convertita in acido carbonico dall’anidrasi carbonica e la maggior parte
dell’acido carbonico si dissocia in ioni idrogeno e ioni bicarbonato, vi è una
relazione inversa tra la P
CO
2
e il pH.
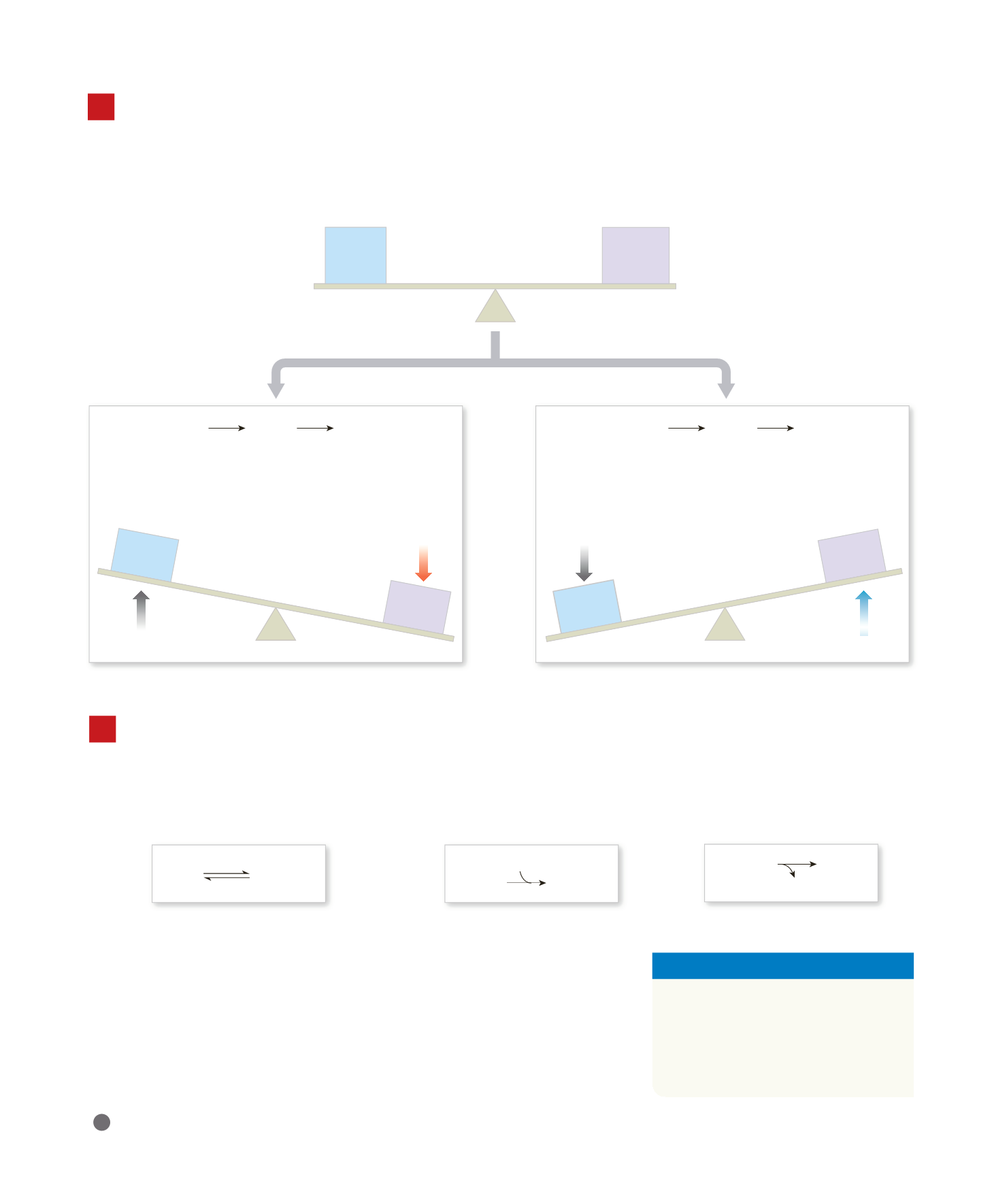
3
Un
sistema tampone
nei liquidi corporei general-
mente consiste in una combinazione di un acido
debole (HY) e di un anione (Y
–
) rilasciato dalla sua disso-
ciazione. L’anione funziona come una base debole. In
soluzione, le molecole dell’acido debole sono in equili-
brio con i suoi prodotti di dissociazione. Da un punto di
vista chimico, questa relazione è rappresentata come:
4
L’aggiunta di ioni H
+
alla
soluzione altera l’equilibrio e
provoca la formazione di
ulteriori molecole di acido
debole.
Anche la rimozione di ioni H
+
dalla soluzione altera l’equili-
brio e provoca la dissociazione
di altre molecole di HY, con
rilascio di ioni H
+
.
Sezione 2: Equilibrio acido-base
•
a.
Definire acidemia e alcalemia.
b.
Quale composto intermedio formato
da acqua e anidride carbonica
influenza direttamente il pH del LEC?
c.
Definire la relazione tra P
CO 2
e pH.
Verifica del modulo .
OA
.
Spiegare il ruolo dei sistemi tampone nel mantenimento dell’equilibrio
acido-base e del pH.
















