
Gli argomenti relativi a pH,
caratteristiche chimiche di
acidi e basi e sistemi tampone sono
stati trattati nel Modulo 2.12
(p. 64)
.
Questa tabella riassume i termini
chiave che saranno impiegati nella
discussione seguente.
1
Un’acidosi severa (pH inferiore a 7,0) può essere letale perché
(1) le funzioni del sistema nervoso centrale si deteriorano e il
paziente può entrare in coma; (2) le contrazioni cardiache
diventano deboli e irregolari e si possono sviluppare i segni e
i sintomi dell’insufficienza miocardica; (3) la vasodilatazione
periferica produce un importante calo pressorio, con la
possibilità di innescare un collasso cardiocircolatorio.
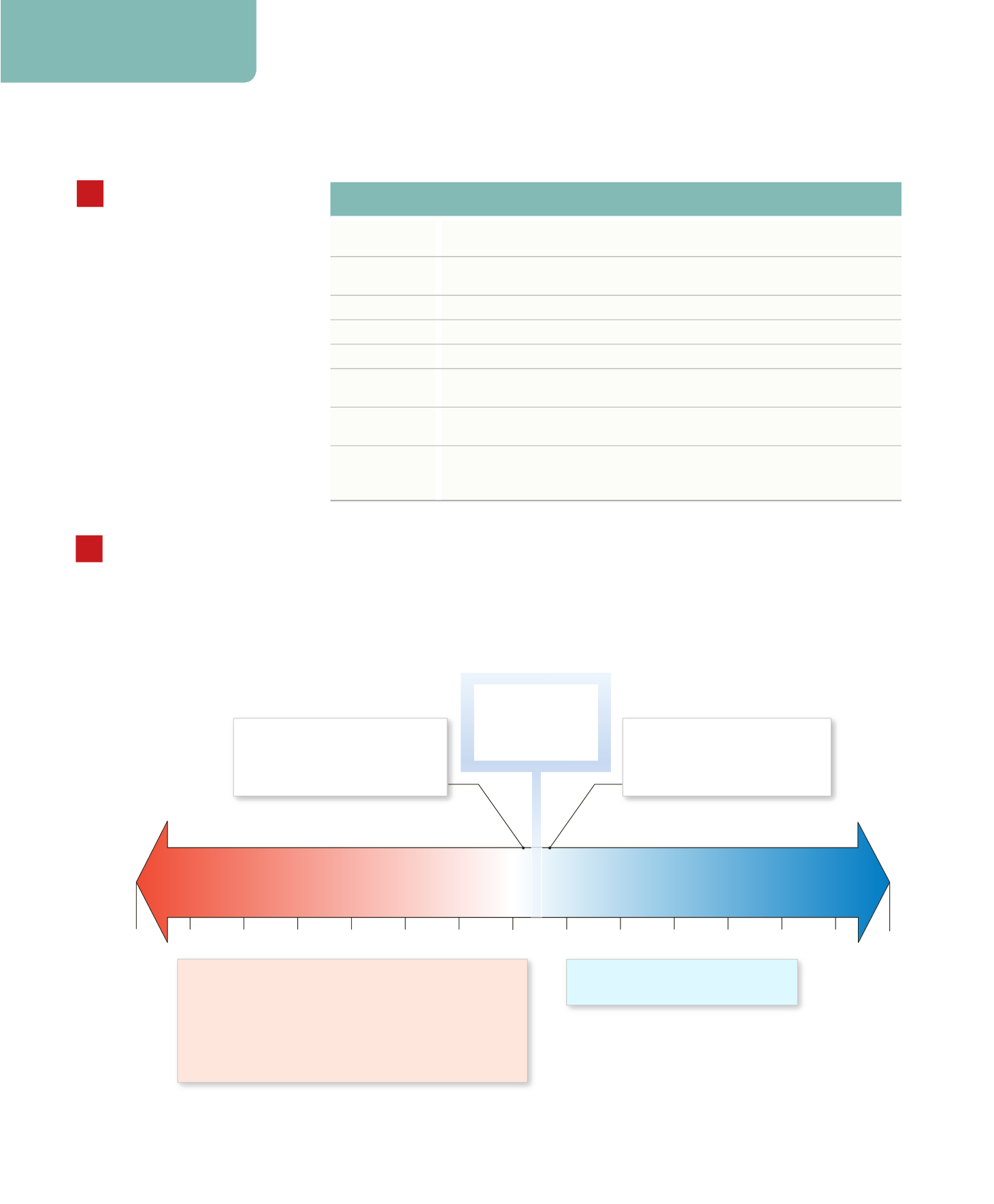
Quando il pH del sangue scende al
di sotto di 7,35 si instaura
acidemia
. Lo stato fisiologico che
ne risulta è chiamato
acidosi
.
Quando il pH del sangue aumenta
al di sopra di 7,45 si instaura
alcalemia
. Lo stato fisiologico che
ne risulta è chiamato
alcalosi
.
Anche un’alcalosi severa è pericolosa,
ma i casi gravi sono relativamente rari.
Il pH del LEC
normalmente varia
tra 7,35 e 7,45.
pH
1
0
2
3
4
5
8
10
11
12
14
13
9
7
6
Estremamente
acido
Estremamente
basico
Il pH del LEC normalmente rimane entro limti relativamente ristretti, di solito tra 7,35 e
7,45. Qualunque deviazione dalla norma è estremamente pericolosa, in quanto variazioni
nella concentrazione di ioni H
+
distruggono la stabilità delle membrane plasmatiche, alterano la
struttura delle proteine e cambiano l’attività di enzimi importanti. Non è possibile sopravvivere a
lungo con un pH del LEC inferiore a 6,8 o superiore a 7,7. In pratica, si osservano più comune-
mente diminuzioni del pH rispetto ad aumenti, in quanto diversi acidi, tra cui l’acido carbonico,
sono generati durante il normale metabolismo cellulare.
Qualunque variazione del pH si ripercuote su tutti i sistemi
corporei, ma il sistema nervoso e l’apparato cardiovascolare
sono particolarmente sensibili alle fluttuazioni del pH.
2
•
Capitolo : Equilibrio dei liquidi, degli elettroliti e acido-base
Modulo .
Termini utilizzati per descrivere l’equilibrio acido-base
pH
Esponente negativo (logaritmo negativo) della concentrazione di ioni idrogeno [H
+
]
in soluzione
Neutra
Una soluzione con pH uguale a 7; la soluzione contiene un numero uguale di ioni
idrogeno (H + ) e ioni idrossido (OH – )
Acida
Una soluzione con pH inferiore a 7; in questa soluzione prevalgono gli ioni idrogeno
Basica (alcalina)
Una soluzione con pH superiore a 7; in questa soluzione prevalgono gli ioni idrossido
Acido
Una sostanza che dissociandosi rilascia ioni idrogeno, facendo diminuire il pH
Base
Una sostanza che dissociandosi rilascia ioni idrossido o cattura ioni idrogeno,
facendo aumentare il pH
Sale
Un composto ionico formato da un catione diverso dall’idrogeno e da un anione
diverso dall’idrossido
Tampone
Una sostanza che tende ad opporsi ai cambiamenti di pH rimuovendo o
rimpiazzando gli ioni idrogeno; nei liquidi corporei i sistemi tampone mantengono il
pH del sangue entro i limiti della norma (7,35–7,45)
Alterazioni potenzialmente pericolose dell’equilibrio
acido-base sono contrastate da sistemi tampone
















