
loro più distanti rispetto allo stato liquido, occupando quindi un
volume maggiore;
la
capacità termica
, che è la capacità che lacqua ha di immagazzi-
nare e liberare una notevole quantità di calore ed è una proprietà
molto importante per gli organismi viventi, perché serve a mante-
nerne stabile la temperatura corporea;
il
potere solvente
, cioè la capacità di sciogliere varie sostanze. Infat-
ti, le sostanze ioniche, le specie polari e le altre molecole capaci di
formare legami a idrogeno sono facilmente solubili in acqua. Per tale
motivo lacqua in natura non esiste mai allo stato puro, ma presenta
sempre disciolti in varia concentrazione diversi soluti. Ne consegue
che si possono definire la
salinità
(cioè la quantità di sali disciolti) e
la
durezza
dellacqua (cioè il contenuto di sali di calcio e magnesio,
oltre che di eventuali metalli pesanti).
Si definisce soluzione una miscela
omogenea tra due o più sostanze:
quella presente in quantità maggiore
è definita
solvente
, mentre quella o
quelle presenti in quantità minori
sono dette
soluti
.
Le sostanze che sono solubili in
acqua sono chiamate
idrofile
, mentre
le molecole apolari, quindi insolubili
in acqua, sono dette
idrofobe
: queste
ultime formano degli agglomerati in
soluzioni acquose e rimangono tra
loro unite grazie alla formazione di
interazioni idrofobiche
, che sono un
particolare tipo di legame debole.
1.3.2. Autoprotolisi e pH
Tutte le specie che si ionizzano in acqua (come gli acidi forti o debo-
li) e anche le stesse molecole dacqua sono sempre lievemente dissocia-
te in ioni H
3
O
+
e ioni OH
-
. Infatti il legame O-H, come tutti i legami
covalenti molto polarizzati, è sensibile allazione esercitata dalle mole-
cole polari circostanti che, attraendo lidrogeno da un lato e lossigeno
dallaltro, possono causarne la rottura. La reazione di ionizzazione o
4
La struttura della materia e le biomolecole
O
O
O
O
O
H
H
H
H
H
H
H
H
H
H
+
+
+
+
–
–
–
–
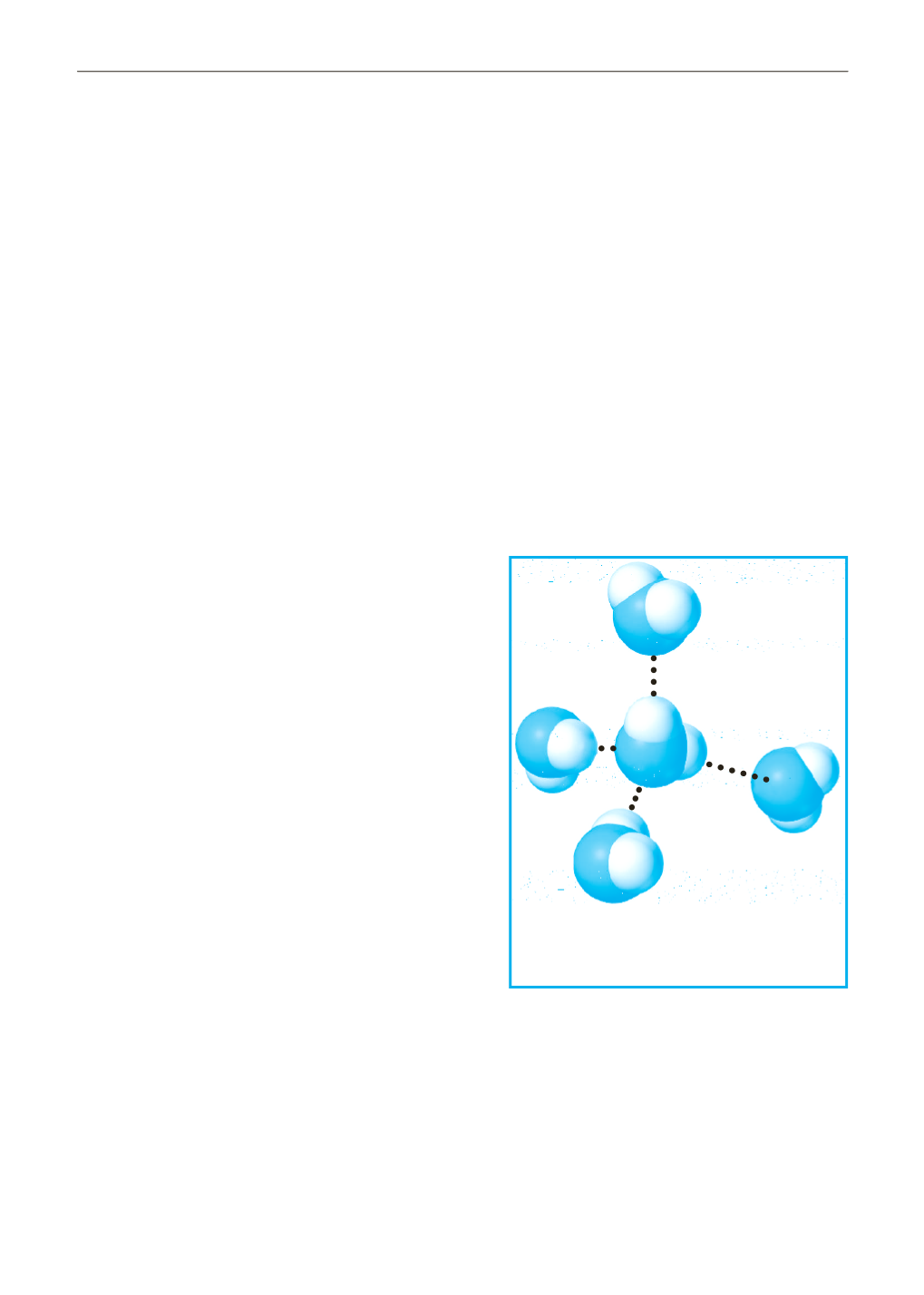
Figura 1-2
Legami a idrogeno
tra molecole dacqua
















