
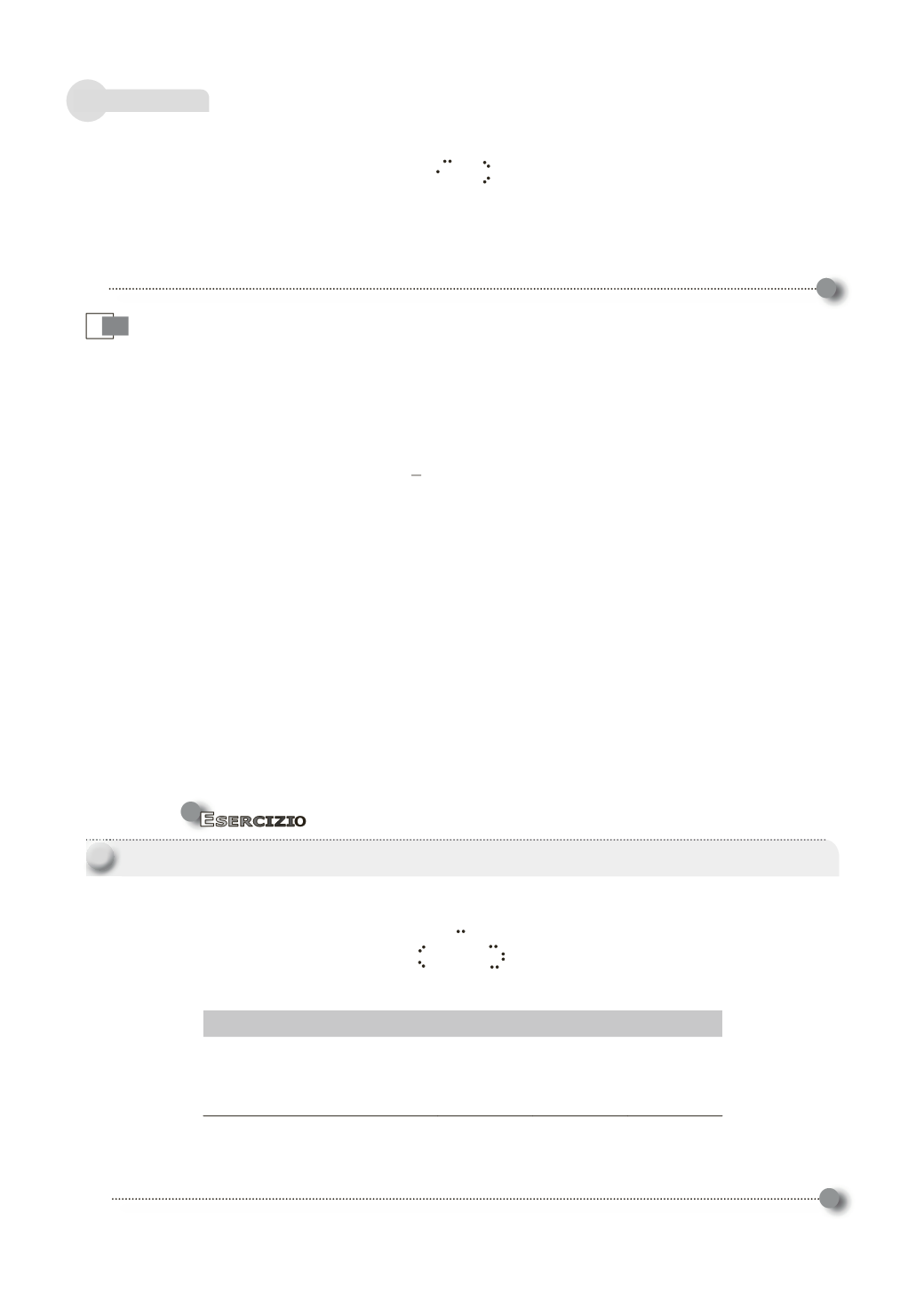
Formule di Lewis
50 Capitolo 3
N
P
O
L’azoto in questa formula possiede 7 elettroni di valenza, che rappresenta la struttura della mo-
lecola di NO. La conversione di un altro doppietto solitario dell’ossigeno a doppietto di legame
porterebbe, infatti, il conteggio elettronico dell’azoto a 9.
3.6 Cariche formali
La
carica formale
di un atomo in una molecola rappresenta la carica che tale atomo avreb-
be se gli elettroni di legame venissero equamente divisi tra gli atomi legati, indipendente-
mente dalla loro elettronegativit
à.
Le cariche formali si calcolano utilizzando la seguente espressione:
carica formale n elettroni di valenza n elettroni di legame n elettroni dei doppietti solitari
1
2
= °
− °
− °
Il termine “formale” sta a indicare che le cariche così calcolate non sono reali.
Il calcolo delle cariche formali consente di individuare strutture di Lewis plausibili che,
pur violando la regola dell’ottetto, devono essere prese in considerazione per rappresenta-
re correttamente la struttura molecolare. È, inoltre, possibile escludere strutture di Lewis
che rispettano la regola dell’ottetto ma che presentano una distribuzione inverosimile delle
cariche formali.
Valgono, in linea generale, le seguenti regole. La struttura di Lewis più plausibile:
– non ha cariche formali;
– se sono presenti cariche formali, queste devono essere le più piccole possibili;
– le cariche formali negative devono trovarsi sull’atomo più elettronegativo;
– se la molecola è neutra, la somma delle cariche formali deve essere uguale a zero; se la
molecola è carica, la somma delle cariche formali deve essere uguale alla carica dello ione.
1
Calcolare le cariche formali nella molecola dell’ozono.
Si applica a ciascuno dei tre atomi di ossigeno l’espressione sopra riportata.
O
K
O
H
O
1
2
3
O(1)
O(2)
O(3)
elettroni di valenza
6
6
6
½ elettroni di legame
2
3
1
elettroni dei doppietti solitari
4
2
6
Carica formale
0
+1
–1
La somma delle cariche formali (0 + 1 – 1 = 0) è zero. La molecola, infatti, è neutra.
















