
514
CAPITOLO #$
Applicazioni delle titolazioni di ossido-riduzione
Lo iodio liberato viene quindi titolato con la soluzione di tiosolfato. La stechiome-
tria della reazione è
1 mol IO
3
2
5
3 mol I
2
5
6 mol S
2
O
3
2
2
ESEMPIO &'()
Una soluzione di tiosolfato di sodio è stata standardizzata sciogliendo in ac-
qua 0,1210 g di KIO
3
(214,00 g/mol), aggiungendo un forte eccesso di KI ed
acidificando con HCl. Lo iodio liberato ha richiesto 41,64 mL della soluzione
di tiosolfato per decolorare il complesso blu amido/iodio. Calcolate la mola-
rità di Na
2
S
2
O
3
.
Soluzione
quantità di Na
2
S
2
O
3
5
0,1210 g KIO
3
3
1 mmol KIO
3
0,21400 g KIO
3
3
6 mmol Na
2
S
2
O
3
mmol KIO
3
5
3,3925 mmol Na
2
S
2
O
3
c
Na
2
S
2
O
3
5
3,3925 mmol Na
2
S
2
O
3
41,64 mL Na
2
S
2
O
3
5
0,08147 M
Altri standard primari per il tiosolfato di sodio sono il bicromato di potassio, il
bromato di potassio, lo iodato acido di potassio, l’esacianoferrato(III) di potassio ed
il rame metallico. Tutti questi composti liberano quantità stechiometriche di iodio se
trattati con un eccesso di ioduro di potassio.
Applicazioni delle soluzioni di tiosolfato di sodio
Numerose sostanze possono essere determinate col metodo indiretto che prevede
la titolazione con tiosolfato di sodio; le applicazioni tipiche sono sintetizzate nella
Tabella 20-2
.
HO
HO
HO
HO
(a)
(b)
HO
OH
n
n
> 1000
O
O
O
O
O
O
O
CH
2
OH
CH
2
OH
CH
2
OH
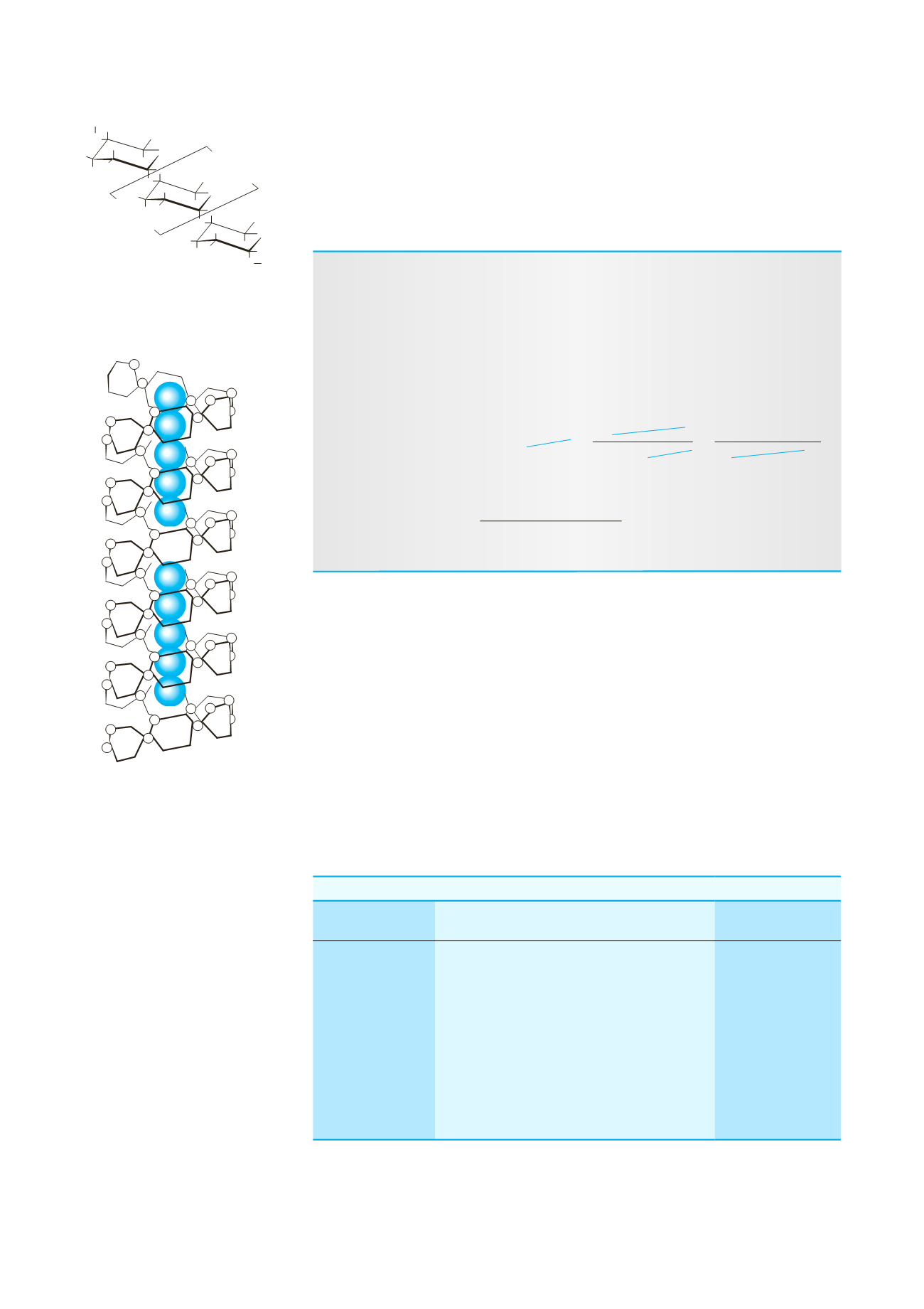
Figura 20-2
Migliaia di molecole
di glucosio polimerizzano per formare
enormi molecole di
b
-amilosio, come
schematicamente illustrato in (a). Le
molecole di
b
-amilosio tendono ad
assumere una struttura ad elica. La
specie iodio I
5
2
, come illustrato in (b),
viene incorporata nell’elica di amilosio.
Per ulteriori dettagli, si veda R. C. Tei-
telbaum, S. L. Ruby, e T. J. Marks,
J.
Amer. Chem. Soc.,
1980
,
102
, 3322.
Copyright 1980 American Chemical
Society.
TABELLA +,-+
Alcune applicazioni del tiosolfato di sodio come riducente
Analita
Semi-reazione
Condizioni
particolari
IO
4
2
IO
4
2
1
8H
1
1
7e
2
8
1
–
2
I
2
1
4H
2
O
Soluzione acida
IO
4
2
1
2H
1
1
2e
2
8
IO
3
2
1
H
2
O
Soluzione neutra
IO
3
2
IO
3
2
1
6H
1
1
5e
2
8
1
–
2
I
2
1
3H
2
O
Acido forte
BrO
3
2
, ClO
3
2
XO
3
2
1
6H
1
1
6e
2
8
X
2
1
3H
2
O
Acido forte
Br
2
, Cl
2
X
2
1
2I
2
8
I
2
1
2X
2
NO
2
2
HNO
2
1
H
1
1
e
2
8
NO(
g
)
1
H
2
O
Cu
2
1
Cu
2
1
1
I
2
1
e
2
8
CuI(
s
)
O
2
O
2
1
4Mn(OH)
2
(
s
)
1
2H
2
O
8
4Mn(OH)
3
(
s
)
Soluzione basica
Mn(OH)
3
(
s
)
1
3H
1
1
e
2
8
Mn
2
1
1
3H
2
O Soluzione acida
O
3
O
3
(
g
)
1
2H
1
1
2e
2
8
O
2
(
g
)
1
H
2
O
Perossido organico ROOH
1
2H
1
1
2e
2
8
ROH
1
H
2
O
















