
510
CAPITOLO #$
Applicazioni delle titolazioni di ossido-riduzione
Per essere utile come preossidante o preriducente, un reagente deve reagire quan-
titativamente con l’analita. Inoltre, ogni eccesso del reagente deve essere facilmente
rimovibile perché tale eccesso di solito interferisce con la titolazione reagendo con
la soluzione standard.
20A-1 Reagenti riducenti ausiliari
Numerosi di metalli sono buoni agenti riducenti e sono stati impiegati per la pre-
riduzione di analiti. Compresi tra questi ci sono: lo zinco, l’alluminio, il cadmio, il
piombo, il nichel, il rame e l’argento (in presenza di ione cloruro). Bastoncini o spi-
rali del metallo possono essere immersi direttamente nella soluzione dell’analita. A ri-
duzione completa, il solido viene rimosso manualmente e risciacquato con acqua. È
necessario filtrare la soluzione dell’analita per eliminare forme granulari o in polvere
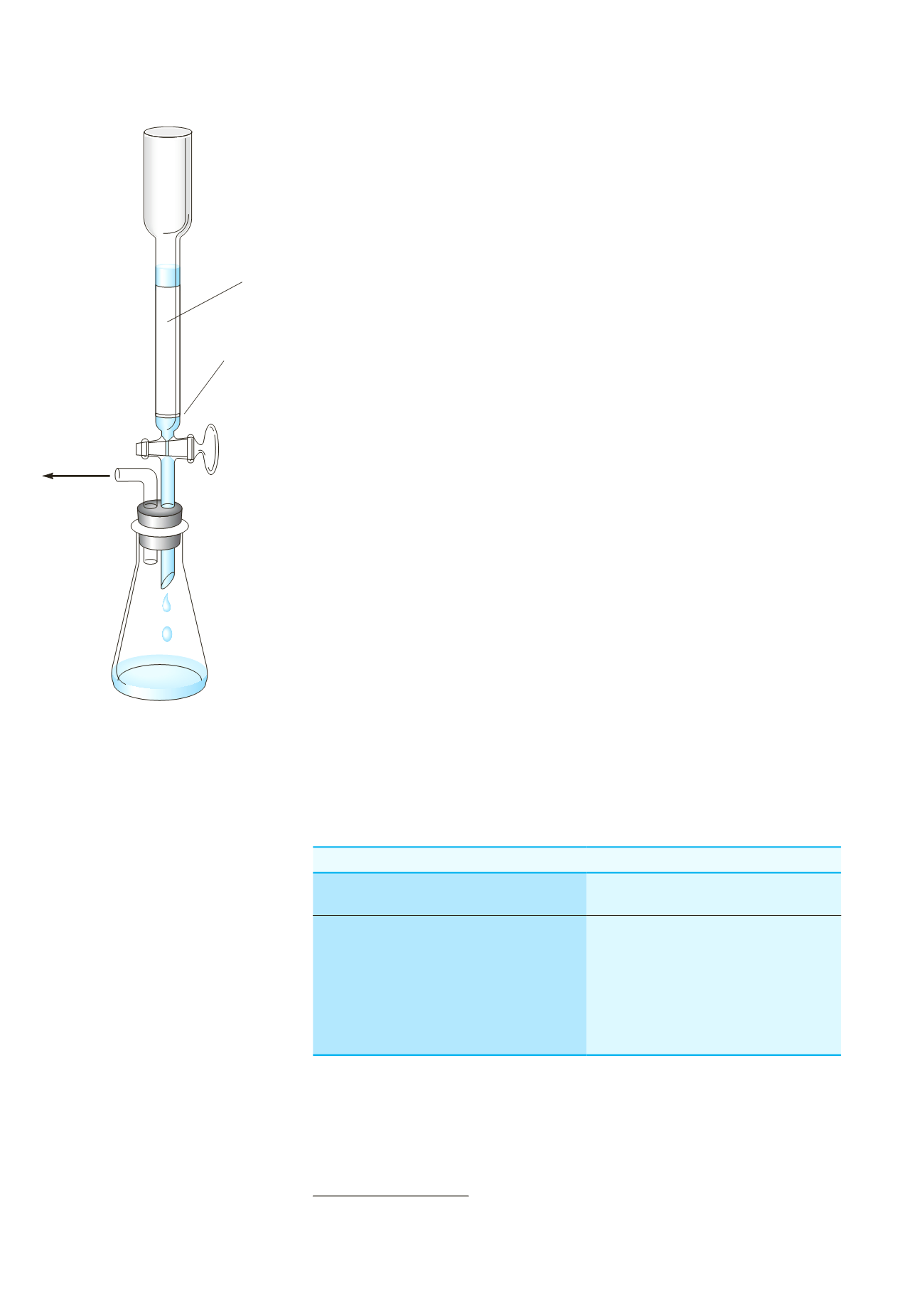
del metallo. Un’alternativa alla filtrazione è l’uso di un
riduttore
, come quello illu-
strato in
Figura 20-1
.
3
In questo caso, il metallo finemente suddiviso è contenuto in
un tubo di vetro verticale attraverso il quale la soluzione viene fatta scendere in con-
dizioni di leggero vuoto. Il metallo in un riduttore è sufficiente di solito per centina-
ia di riduzioni.
Un tipico
riduttore di Jones
ha un diametro di circa 2 cm e contiene una colon-
na da 40-50 cm di zinco amalgamato. L’amalgama viene realizzata lasciando i granu-
li di zinco per breve tempo in una soluzione di cloruro di mercurio(II) nella quale av-
viene la seguente reazione:
2Zn(
s
)
1
Hg
2
1
S
Zn
2
1
1
Zn(Hg)(
s
)
L’amalgama di zinco è efficace per le riduzioni quasi quanto il metallo puro ed ha
l’importante pregio di inibire la riduzione degli ioni idrogeno da parte dello zinco.
Questa reazione parassita non solo consuma inutilmente l’agente riducente, ma con-
tamina anche la soluzione del campione con una grande quantità di ioni zinco(II).
Soluzioni che sono abbastanza acide possono essere fatte passare attraverso un ridut-
tore di Jones senza significativa formazione di idrogeno.
La
Tabella 20-1
elenca le principali applicazioni del riduttore di Jones. In que-
sta tabella vengono anche elencate le riduzioni che possono essere eseguite con un
ri-
3
Per una trattazione dei riduttori, si veda F. Hecht, in
Treatise on Analytical Chemistry,
I. M. Kolthoff e
P. J. Elving, eds., Part I. Vol. 11, pp. 6703–7, New York: Wiley, 1975.
*
Da I.M. Kolthoff e R. Belcher,
Volumetric Analysis,
Vol. 3, p. 12. New York: Interscience, 1957. John Wiley &
Sons, Inc. Per gentile concessione di John Wiley & Sons Inc.
†
Si ottiene una miscela di stati di ossidazione. Il riduttore di Jones può ancora essere usato per l’analisi
dell’uranio, comunque, perché U
2
1
formatosi può essere trasformato in U
4
1
agitando la soluzione all’aria
per pochi minuti.
TABELLA &'()
Usi del riduttore di Walden e del riduttore di Jones*
Walden
Ag(
s
)
1
Cl
2
S
AgCl(
s
)
1
e
2
Jones
Zn(Hg)(
s
)
S
Zn
2
1
1
Hg
1
2e
2
Al vuoto
Amalgama
naturale
Disco perforato
o poroso
Figura 20-1
Un riduttore di Jones.
Fe
3
e
S
Fe
2
Fe
3
e
8
Fe
2
Cu
2
e
S
Cu
Cu
2
2e
8
Cu(
s
)
H
2
MoO
4
2H e
S
MoO
2
2H
2
O H
2
MoO
4
6H 3e
8
Mo
3
3H
2
O
UO
2
2
4H 2e
S
U
4
2H
2
O
UO
2
2
4H 2e
8
U
4
2H
2
O
UO
2
2
4H 3e
8
U
3
2H
2
O
†
V(OH)
4
2H e
S
VO
2
3H
2
O V(OH)
4
4H 3e
8
V
2
4H
2
O
TiO
2
non ridotto
TiO
2
2H e
8
Ti
3
H
2
O
Cr
3
non ridotto
Cr
3
e
8
Cr
2
















