7.1
SPAZIO EXTRACELLULARE
239
a forma di cavo, le quali a loro volta si assemblano in fibre
più spesse che sono sufficientemente grandi da essere vi-
sibili al microscopio ottico. Nella Figura 7.6
b
,
c
è descritto
l’assemblaggio laterale delle molecole di collagene I in una
fibrilla collagene. Le fibrille sono ulteriormente rinforzate
da legami covalenti crociati fra i residui di lisina ed idrossi-
lisina di molecole di collagene adiacenti. Questa formazione
di legami covalenti crociati è un processo che deve durare
per tutta la vita e può, quindi, contribuire alla diminuita ela-
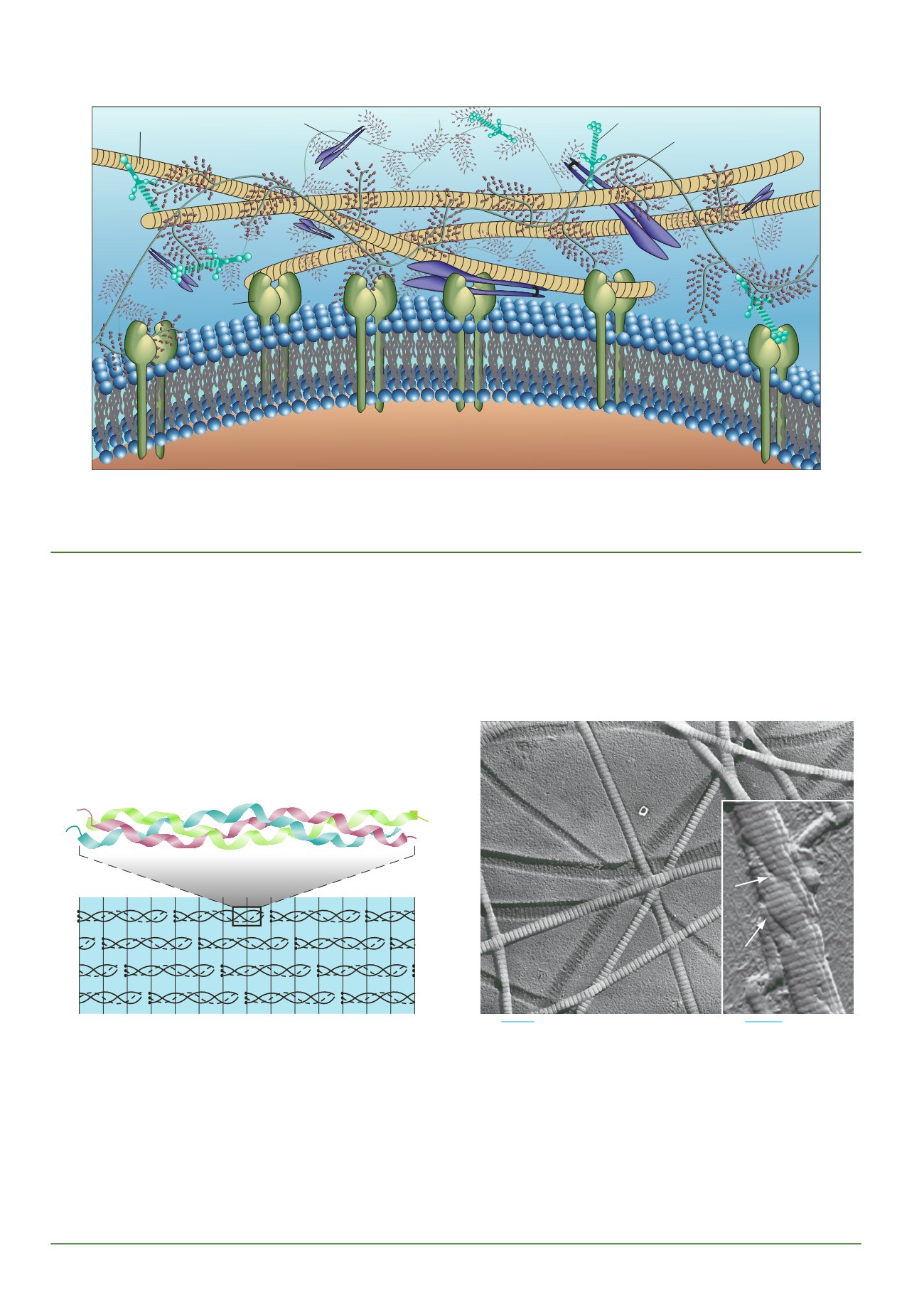
Figura 7.5
Una panoramica dell’organizzazione macromolecolare
della matrice extracellulare.
Le proteine e i polisaccaridi mostrati in
questa illustrazione saranno trattati nei paragrafi successivi. Le pro-
teine rappresentate (fibronectina, collagene e laminina) contengono
siti di legame reciproco e per recettori (integrine) che sono localizzati
sulla superficie delle cellule. I proteoglicani sono enormi complessi
proteine-polisaccaridi che occupano la maggior parte del volume dello
spazio extracellulare.
Laminina
Proteoglicano
Fibronectina
Integrina
Collagene
Figura 7.6
La struttura del collagene I.
Questa figura descrive al-
cuni livelli di organizzazione del collagene fibrillare. (
a
) La molecola
di collagene (monomero) è una tripla elica composta da tre catene ad
a
elica. Alcuni tipi di collagene contengono tre catene
a
identiche
e perciò sono omotrimeri, mentre altri sono eterotrimeri contenenti
due o tre catene differenti. Ciascuna molecola di collagene I ha una
lunghezza di 295 nm. (
b
) Le molecole di collagene di tipo I si alli-
neano in file in modo tale che le molecole di una fila sono sfalsate
rispetto a quelle della fila vicina. Un fascio di molecole di collagene
come quello mostrato in figura costituisce una fibrilla di collagene. La
disposizione sfalsata delle molecole forma bande lungo la fibrilla (linee
orizzontali nere visibili nelle illustrazioni
c
e
d
) che si ripetono con
una periodicità di 67 nm (che è uguale alla lunghezza dell’intervallo
tra molecole più la sovrapposizione delle stesse). (
c
) Fibre di collage-
ne umano al microscopio elettronico osservate dopo ombreggiatura
metallica (vedi Figura 18.15). Il bandeggio delle fibrille è evidente.
(
d
) Micrografia con microscopio a forza atomica della superficie di
una fibrilla di collagene che suggerisce come le sue subcomponenti
siano avvolte a spirale attorno all’asse come in una corda. Il bandeg-
gio rimane evidente. Le frecce indicano i punti dove la fibrilla è leg-
germente despiralizzata, come succederebbe se si girasse una corda
nella direzione opposta all’arrotolamento.
(
C
: P
ER
GENT
.
CONC
.
DI
J
ERO
-
ME
G
ROSS
E
F
RANCIS
O. S
CHMITT
;
D
:
DA
L
AURENT
B
OZEC
ET
AL
., B
IOPHYS
. J.
92:71, 2007.
©
2007,
CON
L
’
AUTORIZZAZIONE DI
E
LSEVIER
.)
(b)
(a)
(c)
(d)
0,3
µ
m
250 nm