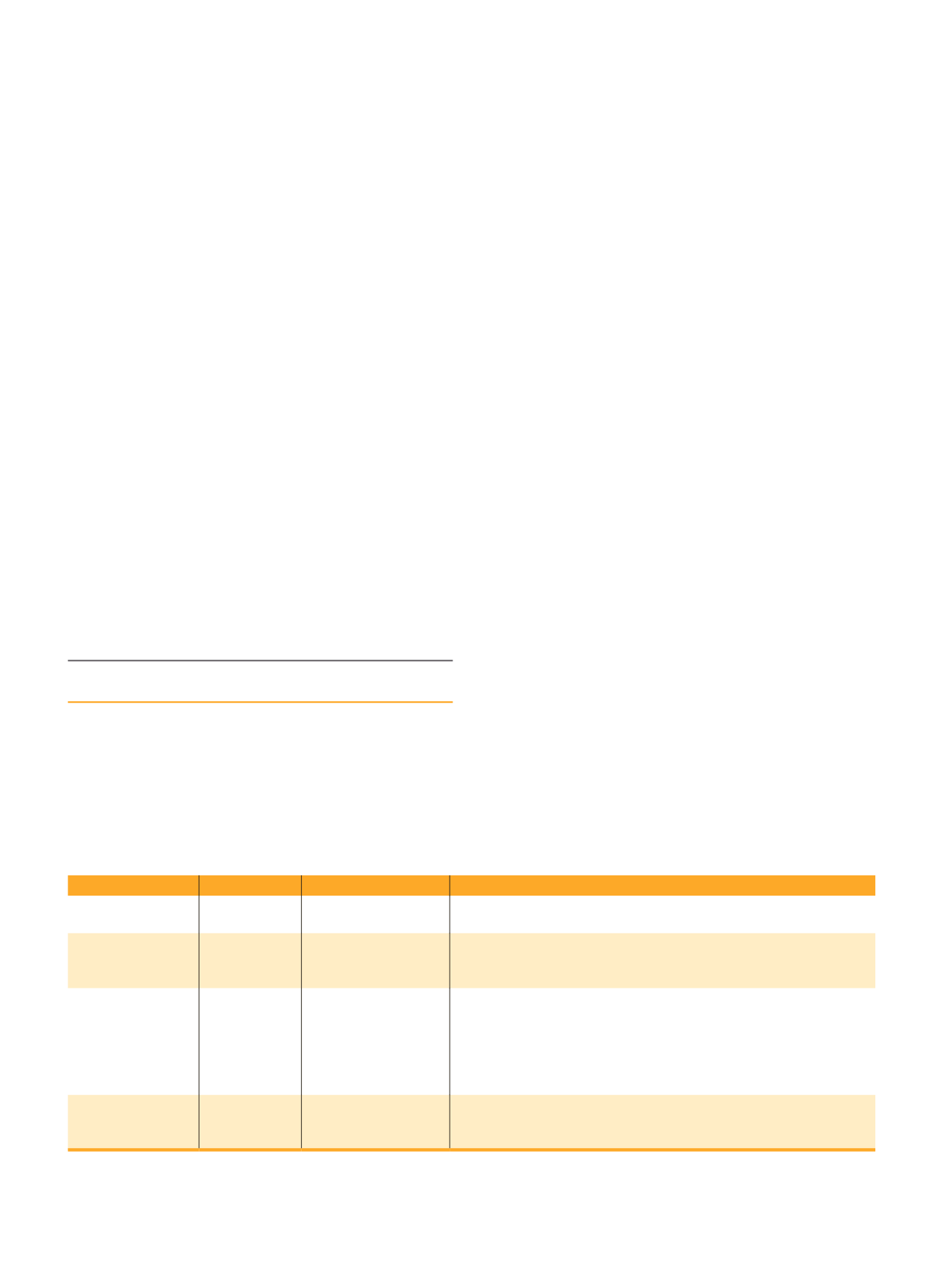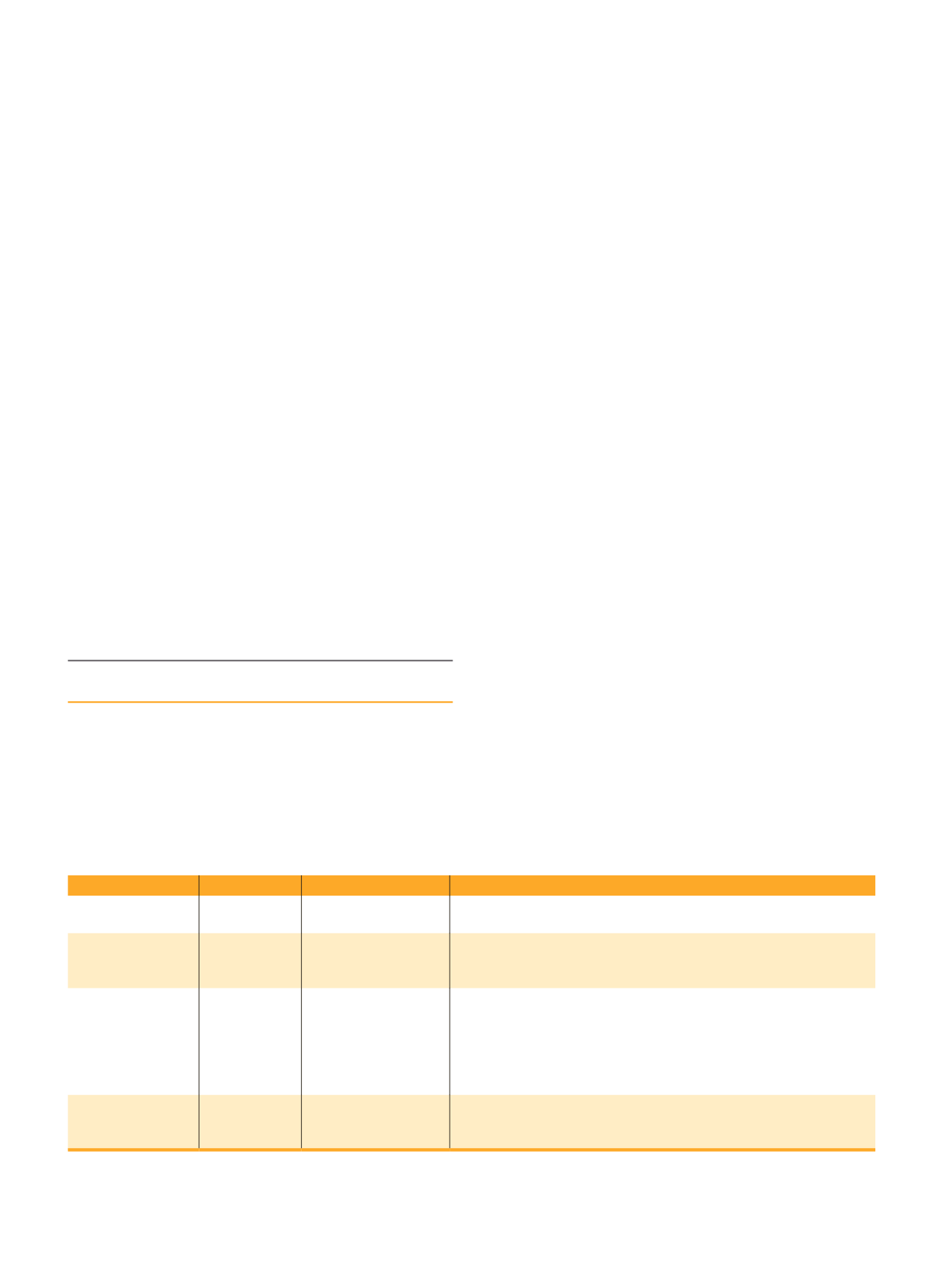
Capitolo 18
[
237
]
MICOBATTERI
scoperta (accidentalmente) da Calmette e Guérin nel-
la prima metà del secolo XX e donominata appunto
BCG
(bacillo di Calmette e Guérin). L’inoculazione di
BCG (per via intracutanea) si accompagna di norma
a modesti segni di reazione locale, con tutt’al più un
interessamento transitorio delle linfoghiandole satel-
liti, ed è seguita dall’instaurarsi di immunità cellulo-
mediata specifica (dimostrabile con la positività alla
intraderemoreazione di Mantoux).
Nei Paesi industrializzati, la vaccinazione non vie-
ne praticata ed il controllo dell’infezione è piuttosto
basato sul controllo capillare della comparsa di posi-
tività alla tubercolina nella prima età scolare e su un
«aggressivo», precoce e protratto trattamento chemio-
terapico dei casi di prima infezione così evidenziati, in
modo da garantire la «sterilizzazione» del complesso
primario (si veda anche pag. 41).
Nei Paesi in via di sviluppo, le condizioni sanitarie
generali non consentono altro intervento che il tratta-
mento di massa con BCG, sulla cui efficacia protettiva,
peraltro, esistono dati molto discordanti che dimo-
strano come siano importanti fattori ambientali, etc.,
nella evoluzione della infezione tubercolare.
Attualmente sono allo studio diversi tipi di vacci-
ni antitubercolari, di cui alcuni basati su tecniche di
manipolazione genetica, e la recente (1998), completa
descrizione della sequenza del genoma di
M. tubercu-
losis
rappresenta una premessa di grande rilievo in
questa prospettiva.
[
]
Micobatteri non-tubercolari
I micobatteri non-tubercolari, comprendono numero-
se specie di micobatteri, significativamente diversi per
vari caratteri biochimici, antigenici e, soprattutto, di
patogenicità per la specie umana, dai micobatteri (
M.
tuberculosis
,
M. africanum
e
M. bovis
) riuniti nel «
My-
cobacterium tuberculosis complex
».
Come abbiamo già detto, si tratta per lo più di conta-
minanti ambientali o di parassiti di varie specie animali,
occasionalmente in grado di infettare l’uomo, general-
mente con il concorso di fattori (immunocompromis-
sione, soprattutto) coadiuvanti (batteri opportunisti).
La classificazione dei micobatteri non-tubercolari
è in evoluzione, e non ha ancora raggiunto un asset-
to definitivo, anche per la continua identificazione di
«nuove» specie, tra le quali sono presenti anche specie
potenzialmente patogene per l’uomo (in particolare
per i soggetti affetti da AIDS).
Una relativamente vecchia classificazione, propo-
sta da Runyon, riunisce i micobatteri non-tubercolari
in 4 gruppi principali, distinti, rispettivamente, a se-
conda del ritmo di crescita nelle colture (a
crescita
lenta
, simile nei tempi a quella di
M. tuberculosis
, o a
crescita rapida
, con sviluppo completo nelle colture,
in meno di 7 giorni) e della produzione (cromogeni)
o meno (non cromogeni o scarsamente cromogeni)
di un’intensa pigmentazione (giallastra) nelle colture
che, a sua volta, si produce solo dopo esposizione ad
una forte sorgente luminosa (batteri
fotocromogeni
)
o anche in assenza di luce (
scotocromogeni
).
Diversi micobatteri non-tubercolari sono anche ri-
uniti in gruppi o «complessi» sulla base di comunanze
biologiche, epidemiologiche e di patogenicità (i «com-
plessi» riuniscono micobatteri che probabilmente sono
varianti biochimiche di un’unica specie originaria).
Nella
tab. 18.1
sono indicate le specie di micobatteri non-tubercolari potenzialmente patogene per
la specie umana, con la indicazione delle situazioni
patologiche indotte con maggiore frequenza e la loro
appartenenza ai diversi gruppi di Runyon ed ai «com-
plessi» già ben definiti.
TABELLA 18.1
Principali micobatteri non-tubercolari associati a infezioni umane
Gruppo di Runyon
«Complesso»
Specie
Patologia umana
I
– fotocromogeni
a crescita lenta
M. marinum
M. kansasii
Infezioni cutanee croniche
Infezione polmonare cronica
II
– scotocromogeni a
crescita lenta
M. scrofulaceum
complex
M. scrofulaceum
M. paratuberculosis(*)
M. szulgai
Linfadenite nella prima infanzia
Infezione polmonare cronica
III
– non cromogeni
o debolmente
cromogeni a crescita
lenta
M. avium
complex
M. avium
M. intracellulare
M. xenopi
M. malmoense
M. haemophilum
M. genevense
Infezioni disseminate particolarmente frequenti in pazienti affetti da AIDS
Infezione polmonare cronica
Infezione polmonare cronica nell’ospite immunocompromesso (AIDS)
Infezioni cutanee e disseminate nell’ospite immunocompromesso.
Linfoadenopatia cervicale
Infezioni disseminate nell’ospite immunocompromesso (AIDS)
IV
– a crescita rapida
M. fortuitum
complex
M. fortuitum
M. chelonei
M. abscessus
Infezioni dei tessuti molli, infezioni disseminate nell’ospite
immunocompromesso, otite media, infezione polmonare cronica
(*) L’infezione umana da
Mycobacterium paratuberculosis
(che, secondo alcuni studiosi, apparterrebbe al
M. avium complex
:
M. avium
subspecie
paratuberculosis
o MAP) è stata
recentemente indicata come la possibile causa della «malattia di Crohn», una grave infiammazione dell’intestino ad andamento cronico e di eziologia ancora sconosciuta.
M.
paratuberculosis
è notoriamente l’agente eziologico della «malattia di Johne» che è un’infiammazione cronica del tratto digerente dei ruminanti, è molto diffuso nell’ambiente
e sopravvive ai correnti procedimenti di pasteurizzazione del latte (15 secondi a 72°C). Anche se il nesso eziologico con la malattia di Crohn è ancora da provare definitivamente,
a livello sanitario internazionale sono in corso una serie di azioni intese ad influire sulle regolamentazioni sanitarie della produzione industriale di cibi, per impedire l’ingresso di
M. paratuberculosis
nella catena alimentare umana.