
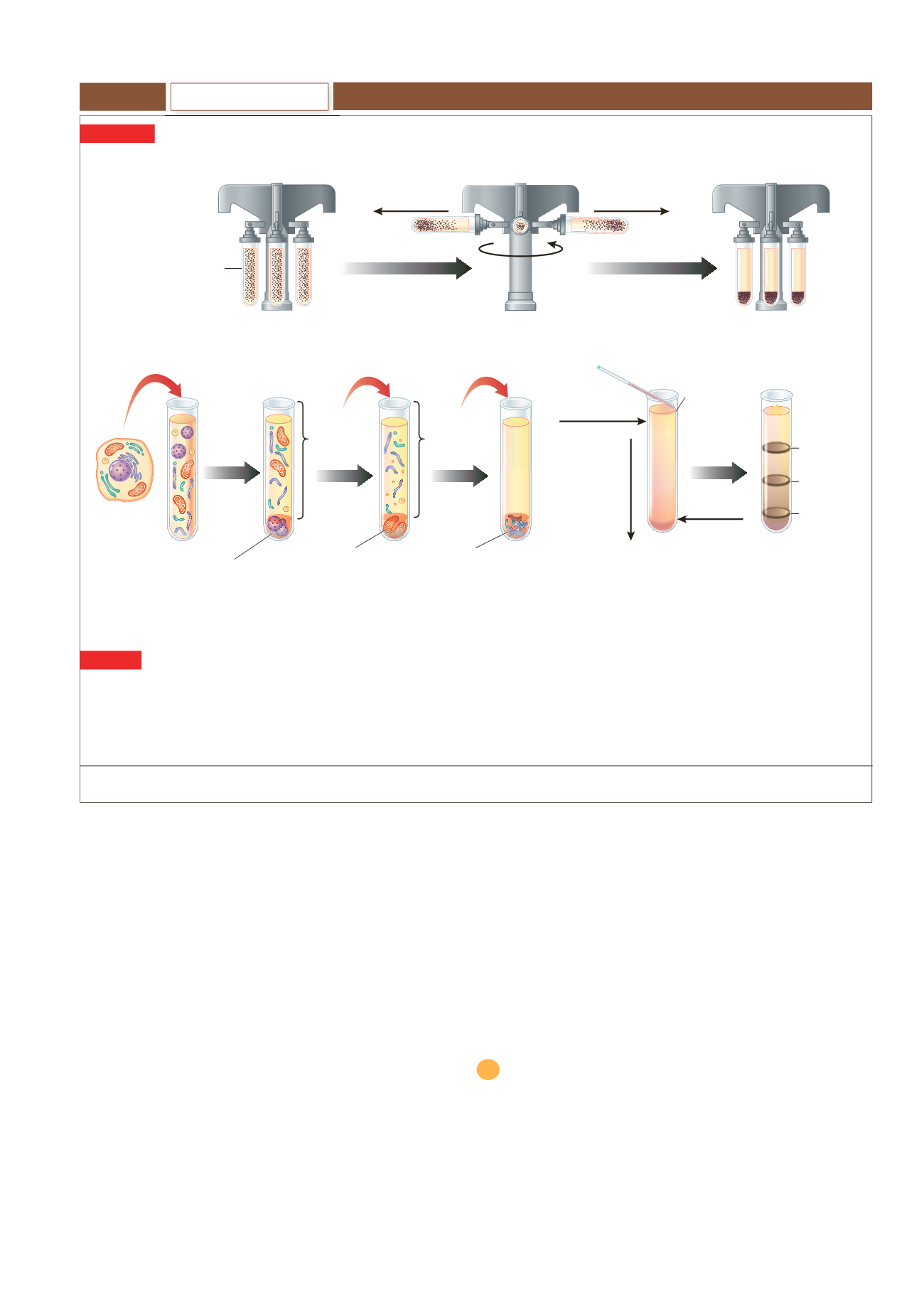
Organizzazione della cellula
!
RE
Golgi
Membrana
plasmatica
100.000
×
G
Risospendere
il pellet
microsomale
e stratificarlo
su un
gradiente di
saccarosio
concentrazione
di saccarosio
Alta
di saccarosio
Gradiente di densità
Pellet microsomale
(contiene RE, Golgi,
membrana plasmatica)
Centrifugare il
supernatante
a 100.000
×
G
90 minuti
Centrifugare il
supernatante
a 20.000
×
G
30 minuti
Mitocondri
e cloroplasti
nel pellet
Nuclei
nel pellet
10 minuti
Centrifugare
a 600
×
G
Cellule lisate
in soluzione
tamponata
Forza centrifuga
Forza centrifuga
Portaprovette oscillante
contenente la provetta
Rotore della centrifuga
(c) Centrifugazione su gradiente di densità.
Bassa
concentrazione
di saccarosio
(a) Centrifugazione.
A causa della forza centrifuga, le particelle molto grandi o molto dense precipitano sul fondo della provetta
e formano un pellet.
(b) Centrifugazione differenziale.
"#$%&'
)* +),?
Il frazionamento cellulare viene utilizzato per separare (frazionare) i componenti
cellulari in funzione della loro dimensione e densità.
%./#
0+12*.1,?
Le cellule vengono rotte in un frullatore. La miscela risultante (omogenato cellulare)
viene poi centrifugata. Come risultato della forza centrifuga, i componenti cellulari più pesanti, i nuclei, formano
un sedimento (pellet) sul fondo della provetta. Il supernatante (il liquido posizionato sopra al pellet) può essere
centrifugato a una velocità maggiore. I componenti più pesanti presenti nel supernatante, come mitocondri
e cloroplasti, formano a loro volta un pellet e il supernatante puo essere centrifugato a una velocità ancora
maggiore. Il processo può essere ripetuto parecchie volte. I pellet possono essere ulteriormente purificati
mediante centrifugazione in gradiente di densità (vedi il testo per spiegazioni più dettagliate).
/#3.4. 4* $*%#$%,
Figura ;-=
Frazionamento cellulare
surare i loro livelli intracellulari e studiare come interagisco-
no con altre proteine. Un’applicazione che viene utilizzata per
identificare proteine si basa sull’impiego di anticorpi che ri-
coprono microsfere di polimeri che possono legarsi e funzio-
nare insieme alle proteine di interesse (
FIG. ;I
). Per esempio,
un anticorpo che è specifico per una subunità proteica del mi-
crotubulo può essere utilizzato per identificare altre proteine
che si legano ai microtubuli e che ne regolano l’attività. Le mi-
crosfere rivestite di anticorpi possono essere aggiunte ad un
estratto cellulare (o ad una frazione cellulare purificata) e in
seguito lavate diverse volte per rimuovere tutte le sostanze pre-
senti nell’estratto che non si sono legate all’anticorpo legato al-
la subunità proteica del microtubulo. Le proteine che invece
rimangono attaccate possono essere staccate dall’anticorpo e
analizzate per determinarne l’identità.
I biologi cellulari usano anche metodi genetici insieme al-
la microscopia o metodi biochimici per collegare le proteine
cellulari alle loro funzioni. Quando una proteina è stata iden-
tificata come una componente critica in una struttura cellula-
re, i ricercatori possono utilizzare metodi di ingegneria gene-
tica per alterare o eliminare il gene che codifica per la proteina
che, effettivamente “spegne” la sua attività. Confrontando le
differenze tra le cellule contenenti la proteina geneticamente
modificata rispetto alle cellule normali, i ricercatori possono
acquisire conoscenze sulla sua funzione e comprendere come
essa interagisce con le altre proteine cellulari.
J
#$*0*%, ;.K
Ņ
%.LL#M,$#
In che modo la risoluzione limita l’efficacia
di ingrandimento che può essere ottenuta con la
microscopia?
Ņ
Quali sono i vantaggi di utilizzare metodi diversi per collegare
la struttura e la funzione delle cellule? Fare degli esempi.
















