
368 Capitolo 12
Alcani
,GURFDUEXUL
$OFDQL
&DSLWROR
&ODVVH
$OFKHQL
&DSLWROR
$OFKLQL
&DSLWROR
$UHQL
&DSLWROR
/HJDPL
FDUERQLR²
FDUERQLR
6ROR OHJDPL
VLQJROL
FDUERQLR²
FDUERQLR
8QR R SL
GRSSL OHJDPL
FDUERQLR²
FDUERQLR
8QR R SL
WULSOL OHJDPL
FDUERQLR²
FDUERQLR
8QR R SL DQHOOL
GL WLSR
EHQ]HQLFR
1RPH
(WDQR
(WHQH
(WLQR
%HQ]HQH
&&
&&
(VHPSLR
&&
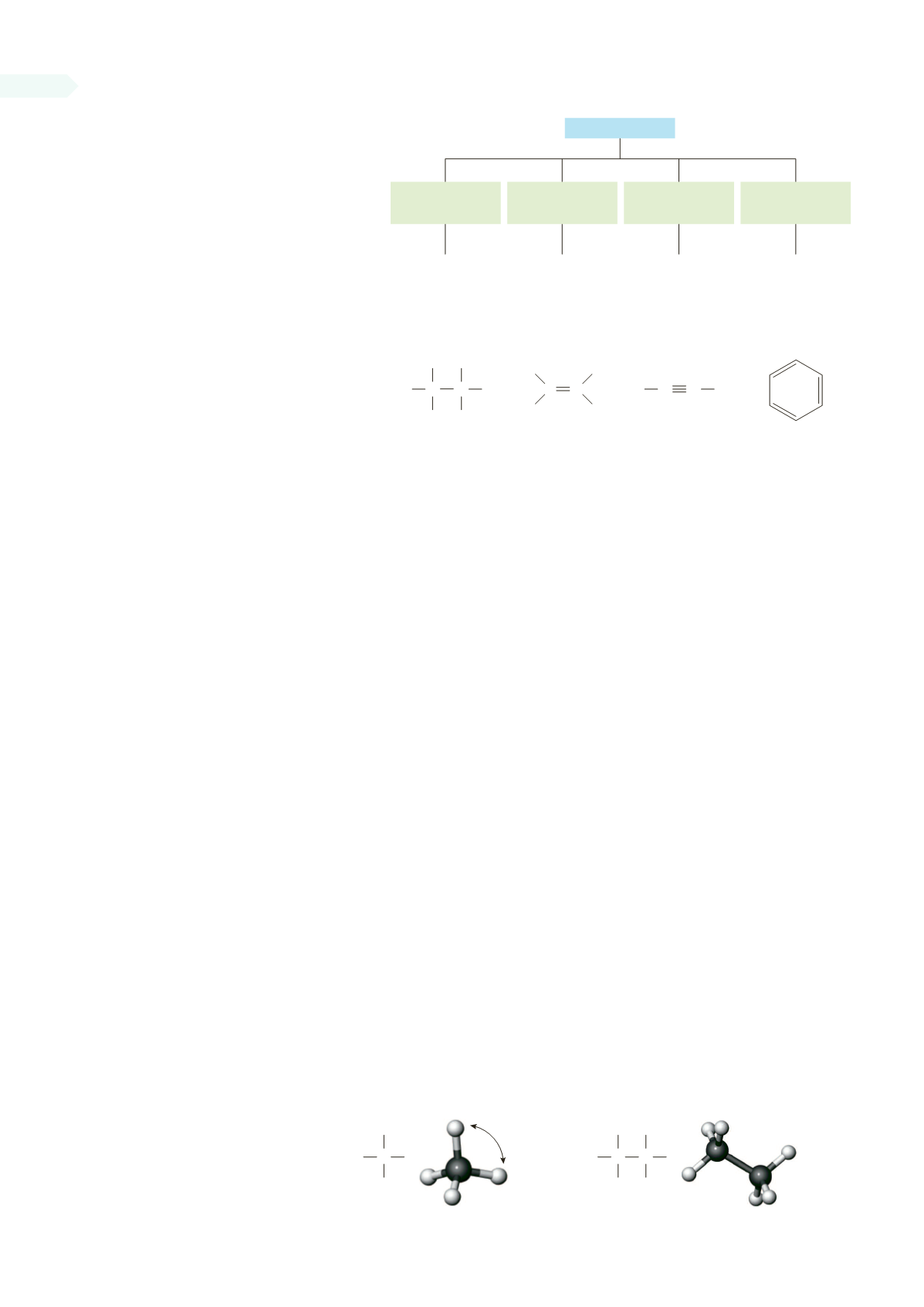
FIGURA 12.1
Le quattro classi di
idrocarburi.
di un anello benzenico. Studieremo gli alcani (idrocarburi saturi) in questo
capitolo e alcheni, alchini ed areni (idrocarburi insaturi) nei Capitoli 13 e 14.
Spesso si indicano gli alcani come
idrocarburi alifatici
, in quanto le
proprietà "siche dei membri superiori di questa classe di composti ricordano
quelle delle molecole a lunga catena carboniosa che si trovano nei grassi ani-
mali e negli oli vegetali (dal Greco:
aleiphar
, grasso o olio).
Il metano, CH
4
, e l’etano, C
2
H
6
, sono i primi due membri della famiglia
degli alcani. La
Figura 12.2
mostra la formula di Lewis ed il modello a sfere
e bastoncini per queste due molecole. La geometria del metano è tetraedrica,
con tutti gli angoli di legame H—C—H di circa 109.5°. Anche nell’etano ogni
atomo di carbonio è tetraedrico, così come gli angoli di legame sono approssi-
mativamente di 109.5°. Nonostante le strutture tridimensionali degli alcani
a catena più lunga siano più complesse di quelle del metano e dell’etano, i
quattro legami intorno ad ogni atomo di carbonio hanno comunque una dispo-
sizione tetraedrica con tutti gli angoli legami di circa 109.5°.
I membri successivi della famiglia degli alcani sono il propano, il butano
e il pentano. Questi idrocarburi sono rappresentati nella "gura alla pagina
seguente nella formula di struttura condensata, che mostra tutti gli atomi di
carbonio e di idrogeno. Essi possono anche essere descritti in una forma ancor
più abbreviata chiamata
formula a linee ed angoli
. In questo tipo di formu-
la ogni linea rappresenta un legame singolo carbonio–carbonio, ogni vertice
un atomo di carbonio e l’estremità di una linea un gruppo —CH
3
. Per contare
gli atomi di idrogeno in una formula a linee ed angoli occorre semplicemente
aggiungere mentalmente ad ogni atomo di carbonio un numero di atomi di
idrogeno tale da consentirgli di formare quattro legami. I chimici usano le
formule a linee ed angoli perché sono più facili e veloci da scrivere rispetto
alle formule di struttura condensate.
FIGURA 12.2
Metano ed etano.
109.5
˚
CH
4
Metano
C H H
H
H
C
2
H
6
Etano
C C H
H
H
H
H
H
Idrocarburo alifatico
Un alcano.
Formula a linee ed angoli
Un modo
abbreviato per scrivere formule di
struttura; in tale formula ogni vertice
rappresenta un atomo di carbonio
ed ogni linea rappresenta un legame
carbonio–carbonio.
















