
456
STUDIO
Chimica
www.
edises
.it
••
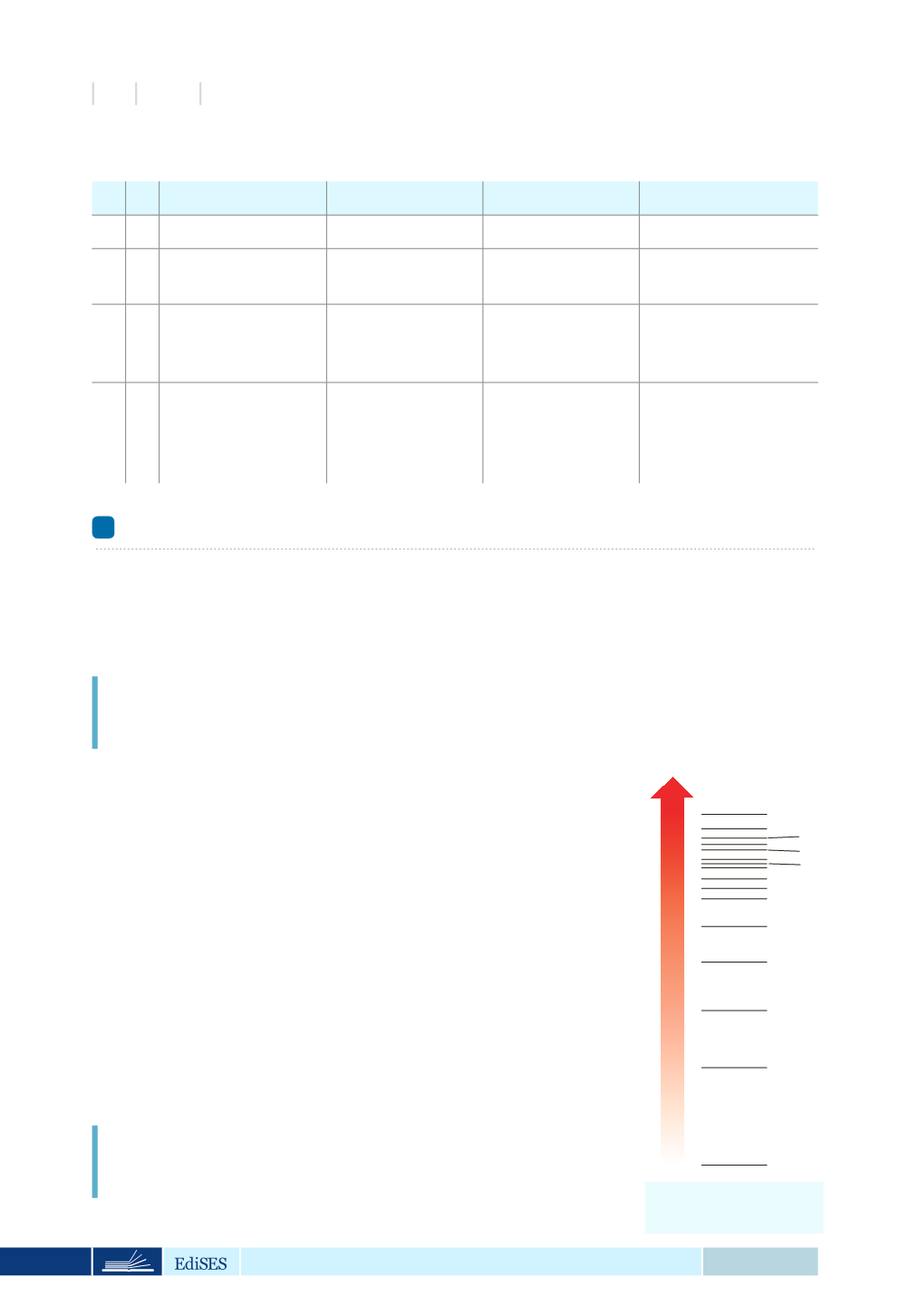
TABELLA 2.3
Numeri quantici, orbitali e sottolivelli
n l
m
Tipo di orbitale Numero di orbitali Numero di sottolivelli
1
0
0
1
s
1
0
2
0
1
0
–1, 0, 1
2
s
2
p
1
3
2
sottolivelli
(2
s
e 2
p
)
3
0
1
2
0
–1, 0, 1
–2, –1, 0, 1, 2
3
s
3
p
3
d
1
3
5
3
sottolivelli
(3
s
, 3
p
, 3
d
)
4
0
1
2
3
0
–1, 0, 1
–2, –1, 0, 1, 2
–3, –2, –1, 0, 1, 2, 3
4
s
4
p
4
d
4
f
1
3
5
7
4
sottolivelli
(4
s
, 4
p
, 4
d
, 4
f
)
2
.
3
•
Configurazioni elettroniche degli atomi
La
configurazione
elettronica
di
un
atomo
o, come si è soliti dire,
di
un
elemento
,
esprime il modo in cui gli elettroni sono distribuiti nei vari orbitali, ai vari livelli o
sottolivelli energetici. Per poterla comprendere sono necessarie, però, alcune cono-
scenze preliminari.
In base al
principio
di Aufbau
, a partire dall’idrogeno (
Z
= 1), ogni elettrone in
più (
Z
= 2, 3, 4, ecc.) va ad occupare l’orbitale con energia più bassa tra quelle pos-
sibili, seguendo una scala definita di energie (Fig. 2.5).
In questo modo si ottiene la configurazione elettronica di un
atomo nel suo
stato
fondamentale
. Occorre tener presente, come
risulta in figura, che talvolta, negli atomi polielettronici, un sot-
tolivello di un livello superiore può avere un’energia inferiore
a quella di un sottolivello che appartiene a un livello inferiore,
come accade ad esempio per i sottolivelli 4
s
e 3
d
e per i sotto-
livelli 5
s
e 4
d
.
Un elettrone può occupare un orbitale in due diversi stati, cioè
ruotando su se stesso
in
senso
orario
o
antiorario
. Questa pos-
sibilità viene espressa mediante un quarto numero quantico, il
numero
quantico
di
spin
(
m
s
) (dall’inglese
to
spin
= ruotare),
che assume i due valori +1/2 e –1/2.
In definitiva,
lo
stato
di un
elettrone
è
determinato
in maniera univo-
ca
dai
valori
dei
quattro numeri
quantici:
n
,
m
,
l
e
m
s
.
Secondo il
principio di esclusione di Pauli
in un atomo non
possono esistere 2 elettroni aventi tutti e quattro i numeri
quantici uguali.
•
•
Figura 2.5
Scala di
energia degli orbitali.
7
s
5
s
3
s
1
s
4
s
4
d
6
s
5
d
4
p
6
p
3
p
2
p
2
s
3
d
5
p
4
f
ENERGIA
















