
www.
edises
.it
CAPITOLO
2
Il modello atomico a orbitali
2
.
1
•
Le basi teoriche del modello a orbitali
Il modello atomico a orbitali è il modello più attuale che indaga sulla composi-
zione dell’atomo e, al contrario dei modelli precedenti, è un modello “proba-
bilistico”. Prima di descriverlo, è opportuno però ricordare brevemente i con-
cetti fondamentali del modello atomico di
Bohr
, in parte superati, ma in parte
accettati nel modello ad orbitali.
Secondo Bohr:
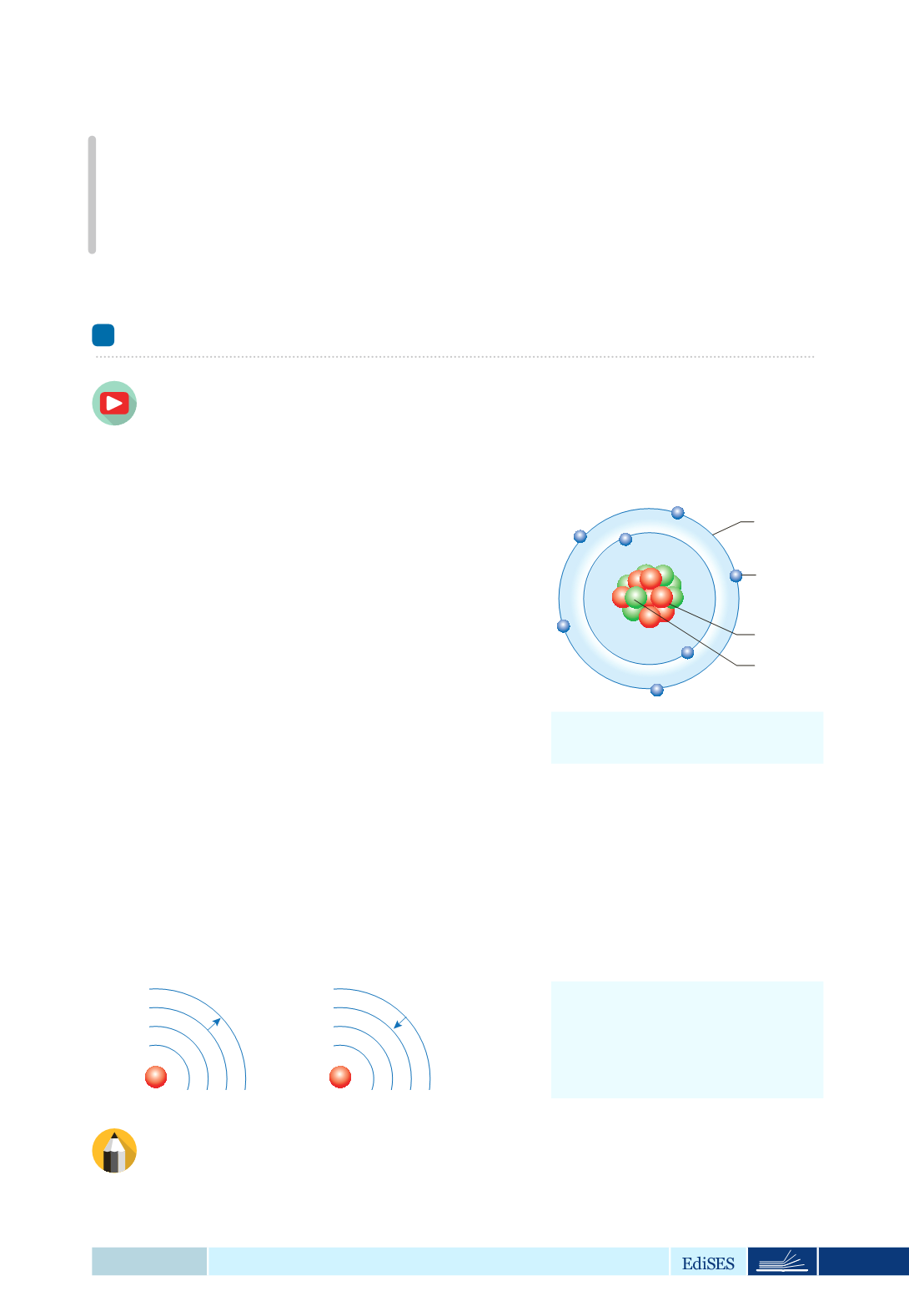
• un elettrone si muove intorno al nucleo seguen-
do precise traiettorie, dette
orbite
, alle quali cor-
rispondono altrettanti
stati
energetici
(Fig. 2.1);
• al crescere del raggio dell’orbita, cresce anche
l’energia dell’elettrone;
• un elettrone che si trovi su una certa orbita, per
esempio con energia E
1
, può passare su quella
cui compete una maggiore energia (E
2
) soltanto
se gli viene fornita la quantità di energia suffi-
ciente, cioè E
2
– E
1
. Il passaggio inverso avviene
con l’emissione della stessa quantità di energia
(Fig. 2.2). In altre parole un elettrone può as-
sorbire o emettere energia soltanto attraverso quantità finite, dette
“quanti”
di
energia
. Questo è il principio della
quantizzazione dell’energia
, che fa parte della
teoria
quantistica
dell’energia
, e rappresentò un caposaldo del modello atomico
di Bohr.
Una conseguenza di questa teoria è che un elettrone non può cadere sul nucleo, in
quanto non può assumere un’energia inferiore alla minima “permessa”, relativa cioè
all’orbita con energia più bassa.
•
•
Figura 2.2
Nel passaggio dall’orbita
3 all’orbita 4 l’elettrone deve assorbire
una quantità di energia paria a E
4
– E
3
,
che viene invece emessa quando l’elet-
trone torna sull’orbita 3.
–
–
+
Nucleo
1 2 3 4
Assorbimento
di energia
+
Nucleo
1 2 3 4
Emissione
di energia
Il modello atomico ad orbitali si basa sui seguenti presupposti:
Gli
elettroni hanno una doppia natura
, come la luce:
corpuscolare
e
ondula-
toria
, secondo quanto affermato dal fisico De Broglie.
•
•
Figura 2.1
Modello atomico dell'a-
zoto secondo Bohr.
Orbita
Elettroni
Protoni
Neutroni
++
+
+ +
+ +
–
–
–
–
–
–
–
















