
3.5 Proprietà periodiche degli elementi
79
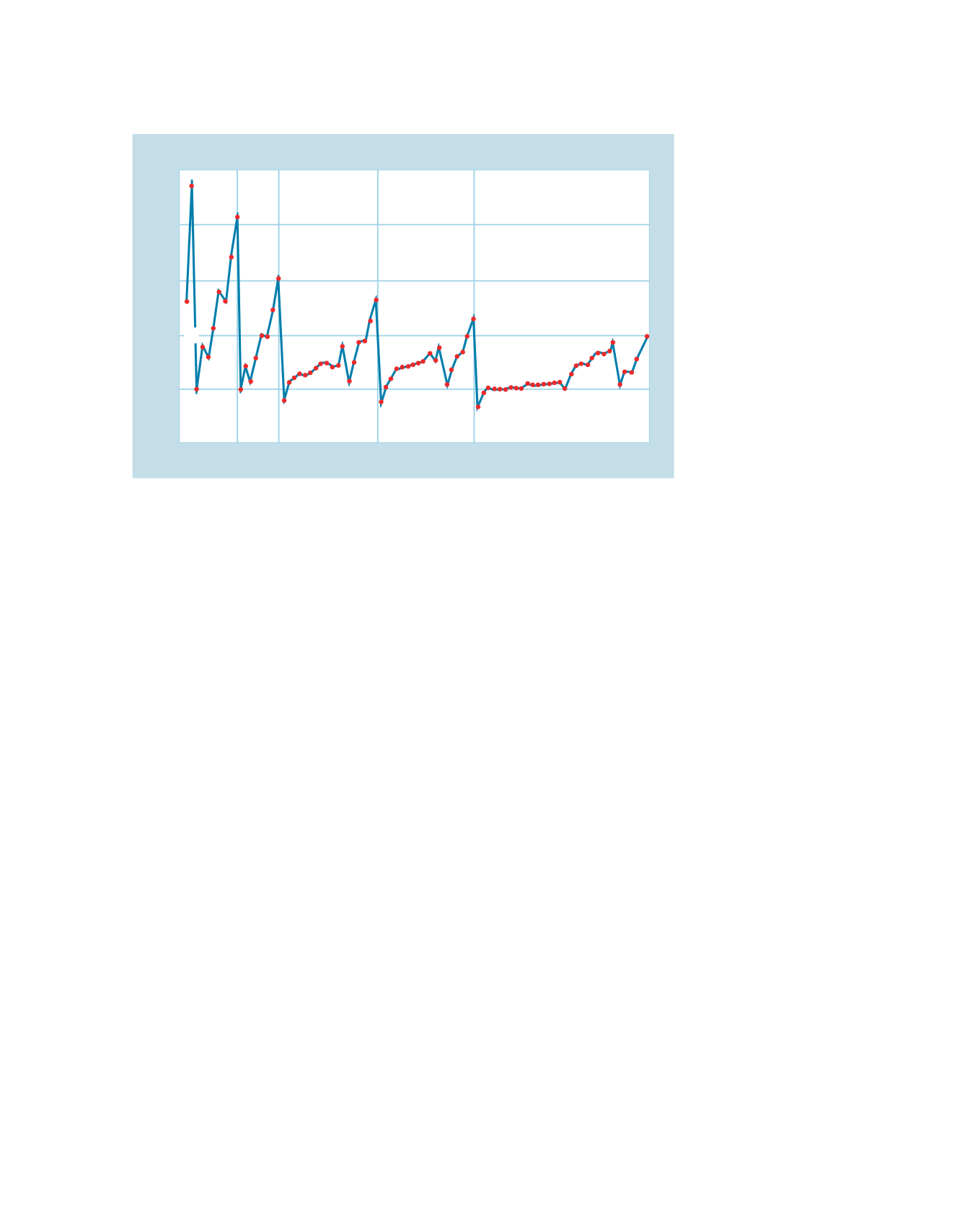
Gli elementi che presentano i più alti valori di energia di ionizzazione sono i
gas nobili, mentre quelli con i valori più bassi sono i metalli alcalini. L’elio pos-
siede il valore massimo dell’energia di ionizzazione mentre il cesio presenta il
valore più basso.
Gli alti valori delle energie di ionizzazione degli elementi del gruppo 0 indi-
cano una configurazione particolarmente stabile dalla quale è molto difficile ri-
muovere un elettrone. Invece i bassi valori delle energie di ionizzazione riscon-
trati per i metalli alcalini sono correlati con una struttura particolarmente sta-
bile degli ioni che si ottengono per rimozione di un elettrone, cioè la stessa con-
figurazione dei gas nobili.
L’aumento dei valori dell’energia di ionizzazione lungo un periodo è giusti-
ficato dall’aumento costante della carica nucleare al crescere del numero ato-
mico e dalla continua diminuzione delle dimensioni atomiche. Infatti, l’au-
mento della forza di attrazione e la maggiore vicinanza al nucleo rendono sem-
pre più difficile l’allontanamento dell’elettrone.
L’energia di ionizzazione dell’elio è superiore a quella dell’idrogeno poiché
l’aumentata carica nucleare rende più difficile allontanare un elettrone dall’a-
tomo di He. Invece l’energia di ionizzazione del litio (avente configurazione
elettronica 1s
2
2s
1
), è notevolmente più bassa di quella dell’elio (1s
2
) poiché l’e-
lettrone che occupa l’orbitale 2s è parzialmente schermato dall’interazione con
il nucleo degli elettroni dell’orbitale 1s. Un analogo effetto di schermo si verifica
quando l’orbitale 2s è completamente riempito, per cui l’energia di ionizzazione
del boro (1s
2
2s
2
2p
1
) risulta inferiore a quella del berillio (1s
2
2s
2
).
L’energia di ionizzazione dell’ossigeno (1s
2
2s
2
2p
4
) è più bassa di quella del-
l’azoto (1s
2
2s
2
2p
3
) poiché la repulsione tra due elettroni che occupano lo stesso
orbitale di tipo p è sufficiente ad annullare l’effetto dell’aumento della carica
nucleare e della diminuzione del raggio atomico. Introducendo altri elettroni,
come nel caso del fluoro e del neon, l’aumentata carica nucleare prevale sulla re-
pulsione fra gli elettroni che occupano lo stesso orbitale.
2500
2000
1500
1000
500
0
10 18
36
54
86
Numero atomico
Energia di ionizzazione (KJ/mol)
He
Ne
F
N
C
O
B
Li
Be
H
Ar
P
Mg
Na
K
Zn
As
Br
Kr
Rb
Cd
Xe
Cs
Ti
Rn
Figura 3.8
Valori delle energie di ionizzazione degli elementi in funzione del numero atomico.
















