
stanza maggiore dal nucleo e conseguentemente il raggio atomico cresce. Spo-
standosi lungo un periodo non si ha variazione del numero quantico principale,
ma l’aumento della carica nucleare determina una maggiore attrazione degli
elettroni di valenza da parte del nucleo per cui si ha contrazione del volume ato-
mico dell’atomo e conseguente diminuzione del suo raggio.
Gli elementi delle serie di transizione non presentano variazioni notevoli dei
raggi atomici con il numero atomico. Questo comportamento può esssere spie-
gato tenendo conto che il progressivo aumento della carica nucleare risulta bi-
lanciato dall’azione schermante esercitata dagli elettroni più interni di tipo d
sugli elettroni più esterni di tipo s.
La perdita o l’acquisto di un elettrone da parte di un atomo lo trasforma in
una particella carica positivamente o negativamente, che prende il nome di
ione
(gli ioni positivi vengono chiamati
cationi
, quelli negativi
anioni
). Come mo-
strato nella Figura 3.6, i
raggi ionici
dei vari elementi possono essere ottenuti as-
sumendo che la distanza tra i nuclei degli ioni adiacenti in un cristallo ionico
(vedi Capitolo 4) sia pari alla somma dei raggi del catione e dell’anione.
Le dimensioni di un atomo sono determinate dalle forze di attrazione eser-
citate sugli elettroni esterni dalla carica nucleare effettiva, Z
eff
. L’entità di Z
eff
di-
pende dalla carica nucleare positiva e dall’azione schermante degli elettroni più
interni. Quando un atomo è trasformato in ione positivo, si ha una contrazione
del suo volume poiché si verifica un aumento netto della carica nucleare effet-
tiva dovuto alla diminuzione del numero degli elettroni. Al contrario uno ione
negativo è sempre più grande dell’atomo neutro dal quale deriva, poiché vi è
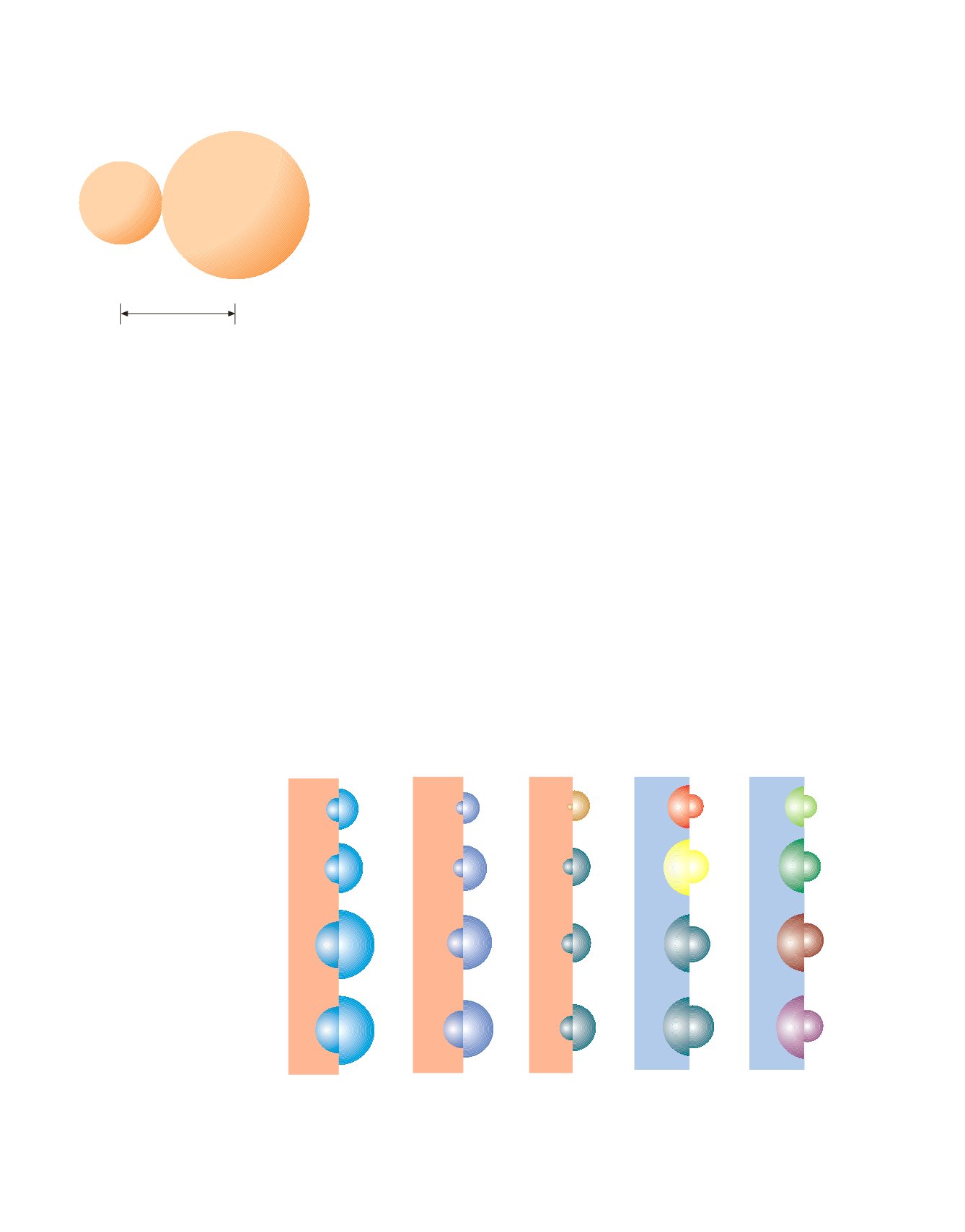
una diminuzione della carica effettiva del nucleo. Nella Figura 3.7 è mostrato un
confronto tra le dimensioni di alcuni atomi e dei loro ioni.
Anche i raggi ionici, come i raggi atomici, mostrano variazioni regolari con il
numero atomico. Il raggio ionico aumenta quando ci si sposta verso il basso
lungo un gruppo poiché gli elettroni si trovano a distanze via via crescenti dal
nucleo.
76
Capitolo 3 Il sistema periodico
Na
+
Cl
–
r
Na
+
+ r
Cl
–
Figura 3.6
Distanza interionica e raggi ionici in un
cristallo di NaCl.
Figura 3.7
Dimensioni relative di atomi e ioni.
Gruppo 1
Gruppo 2
Gruppo 13
Gruppo 16
Gruppo 17
Li
+
76
Na
+
102
K
+
151
Rb
+
161
Li
155
Na
190
K
235
Rb
248
Be
2+
45
Mg
2+
66
Ca
2+
100
Sr
2+
126
Be
112
Mg
160
Ca
197
Sr
215
B
3+
23
Al
3+
51
Ga
3+
62
In
3+
80
B
88
Al
143
Ga
122
In
162
O
2–
140
S
2–
184
Se
2–
198
Te
2–
207
O
66
S
104
Se
117
Te
137
F
–
133
Cl
–
181
Br
–
196
I
–
220
F
64
Cl
100
Br
114
I
133
















