
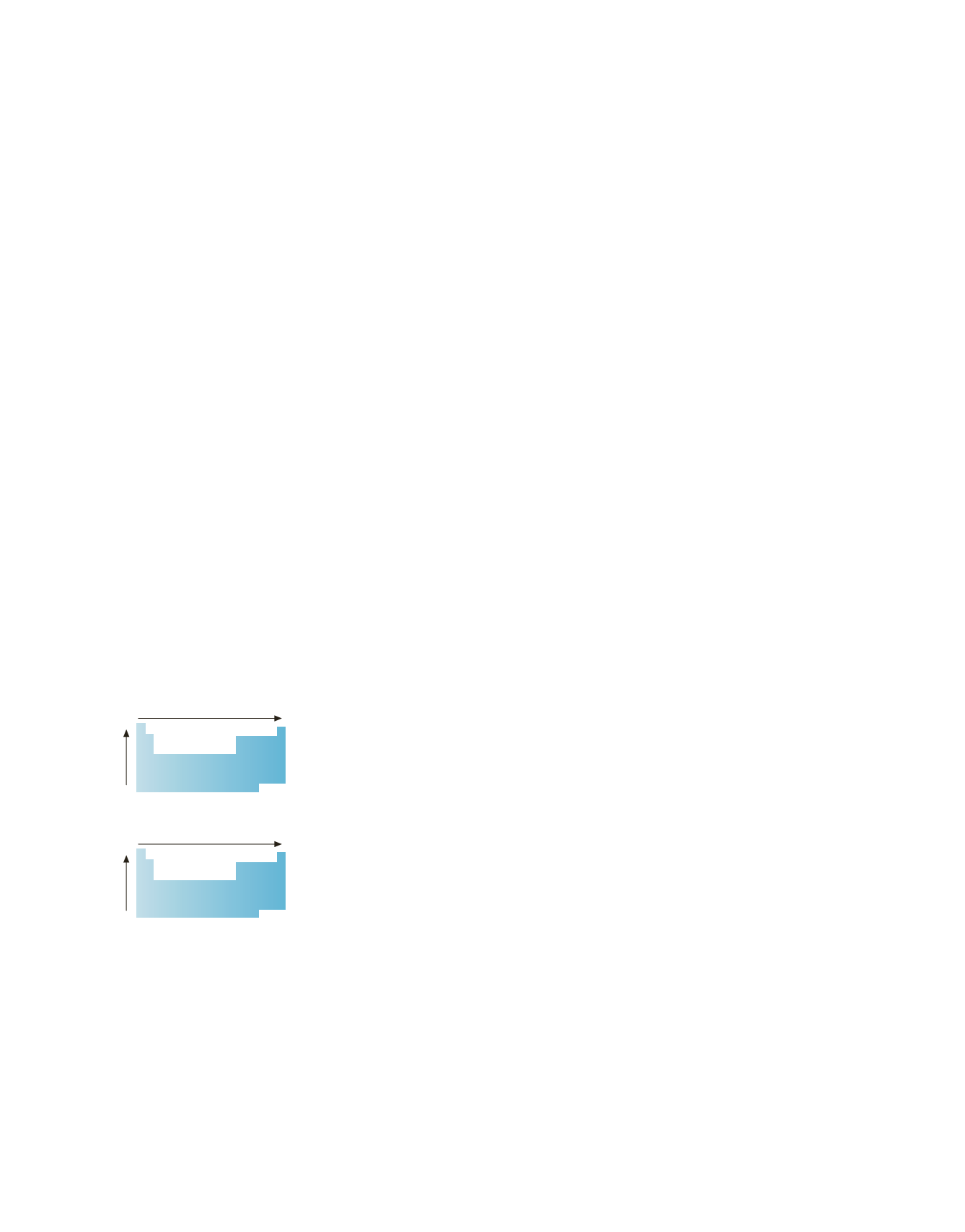
Procedendo dall’alto verso il basso lungo un gruppo si osserva una progres-
siva diminuzione dei valori dell’energia di ionizzazione. Ciò è una conseguenza
dell’aumento del numero quantico principale che corrisponde ad una maggiore
distanza dell’elettrone dal nucleo.
All’interno delle serie di transizione non vi sono notevoli differenze tra i va-
lori dell’energia di ionizzazione poiché gli elementi non presentano variazioni
notevoli dei raggi atomici. Bisogna osservare che le configurazioni elettroniche,
nelle quali orbitali d o f sono completamente occupati da elettroni con lo stesso
spin (d
5
o f
7
), sono molto più stabili di configurazioni contenenti un elettrone in
più o in meno rispetto a questo numero.
Nel sesto periodo le energie di ionizzazione dei metalli di transizione sono più
alte di quelle dei corrispondenti elementi del quarto e del quinto periodo. Ciò è
spiegato dalla comparsa dei quattordici elementi appartenenti alle terre rare che
riempiono gli orbitali 4f prima che si inizi il riempimento degli orbitali 5d. Le
maggiori energie di ionizzazione dei metalli della terza serie di transizione riflet-
tono quindi l’aumento della carica nucleare dovuto all’inserimento dei lantanidi.
L’energia di seconda ionizzazione di un elemento è sempre maggiore della
prima perché il secondo elettrone viene rimosso da uno ione positivo invece che
da un atomo neutro. Nel caso dei metalli alcalini (gruppo I A) l’energia di se-
conda ionizzazione è di gran lunga più elevata di quella di prima ionizzazione in
quanto il secondo elettrone viene strappato ad uno ione che ha la configura-
zione stabile di un gas nobile. Al contrario gli elementi del secondo gruppo
hanno i più bassi valori di energia di seconda ionizzazione perché perdendo i
due elettroni esterni raggiungono la configurazione elettronica del gas nobile
che li precede nel sistema periodico.
3.5.3 Affinità elettronica
Per determinare le proprietà chimiche di un elemento è importante cono-
scere anche la sua tendenza ad assumere elettroni. Essa è misurata dall’
affinità
elettronica
che è definita come l’energia che viene liberata da un atomo neutro
isolato allo stato gassoso quando esso acquista un elettrone in uno degli orbitali
esterni vuoto o semivuoto, trasformandosi in uno ione negativo:
A(g) + e
–
⎯→
A
–
(g)
Non è facile misurare sperimentalmente l’affinità elettronica dei vari ele-
menti, per cui i suoi valori sono ottenuti in maniera indiretta e sono spesso af-
fetti da incertezze non trascurabili.
Come l’energia di ionizzazione, anche l’affinità elettronica viene riferita ad
una mole di atomi e si esprime generalmente in kJ
•
mol
–1
. Nella Tabella 3.4 sono
riportati i valori di affinità elettronica,
AE
, per quegli elementi per i quali è stato
possibile determinarla con una certa precisione. Occorre notare che le affinità elet-
troniche possono essere espresse sia da numeri negativi che positivi. In quest’ul-
timo caso, l’affinità elettronica non misura una tendenza dell’elettrone ad unirsi al-
l’atomo, ma piuttosto una difficoltà che si incontra quando un elettrone viene ac-
quistato da un atomo. Elevati valori negativi dell’affinità elettronica indicano
quindi un’elevata tendenza dell’elemento ad assumere un elettrone.
L’andamento periodico dell’affinità elettronica in valore assoluto è legato a
quello corrispondente delle energie di ionizzazione. Infatti, muovendosi lungo
un periodo da sinistra verso destra, i valori dell’affinità elettronica generalmente
aumentano così come accade spostandosi dal basso verso l’alto lungo un
gruppo.
80
Capitolo 3 Il sistema periodico
Energia di ionizzazione
Affinità elettronica
(valore assoluto)
Aumento
Aumento
Aumento
Aumento
Il modo in cui variano l’energia di ionizza-
zione (sopra) e l’affinità elettronica in va-
lore assoluto (sotto) all’interno della tavola
periodica.
















