
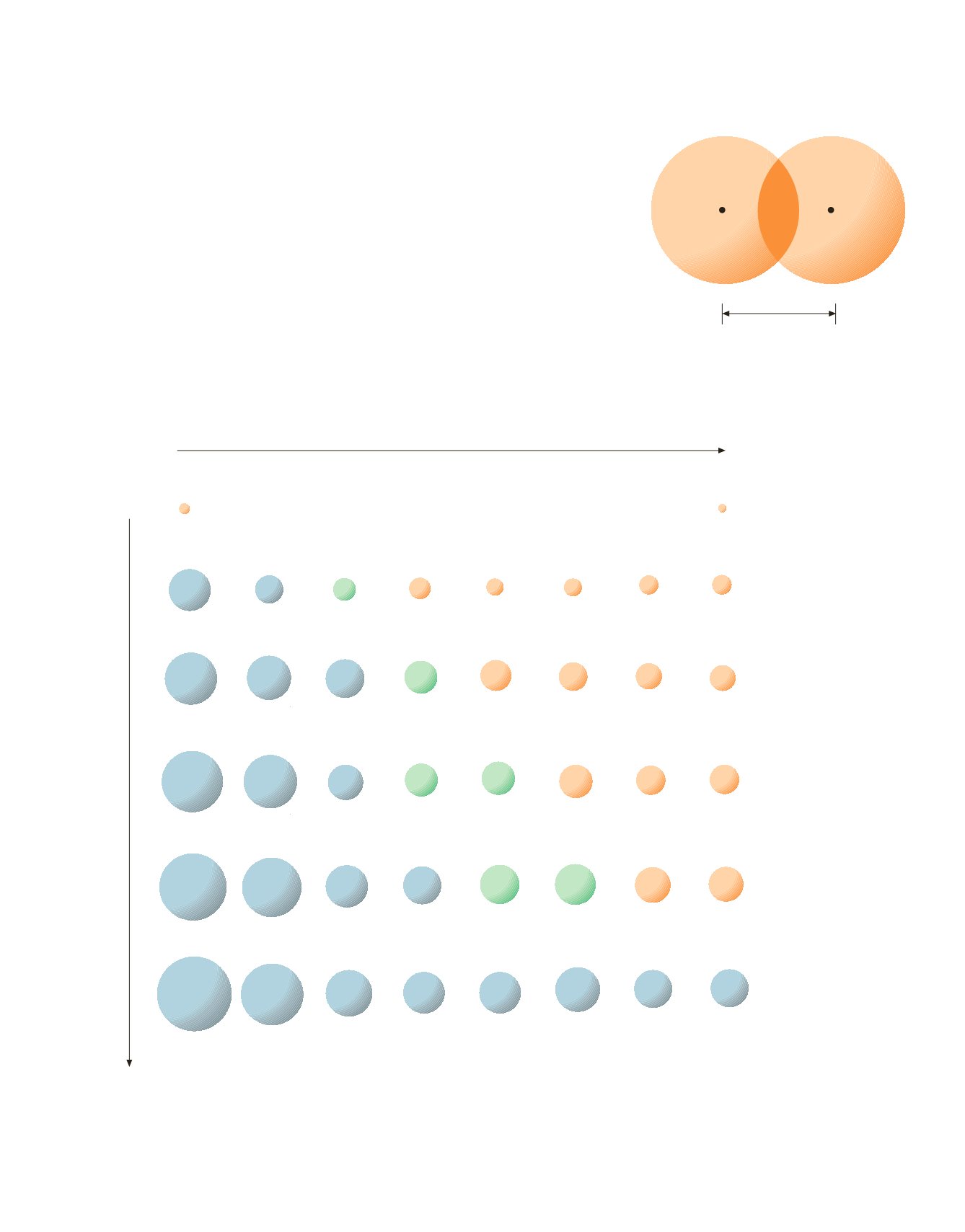
3.5 Proprietà periodiche degli elementi
75
I
raggi atomici
dei vari elementi possono essere ricavati misurando speri-
mentalmente le distanze tra i nuclei di due atomi uguali nei solidi o nelle mole-
cole gassose. Considerando gli atomi come particelle sferiche, il valore del rag-
gio atomico viene assunto pari alla metà della distanza tra i centri dei due atomi
adiacenti (vedi Figura 3.4).
I raggi atomici dei vari elementi sono riportati nella Figura 3.5, dove i cerchi
rappresentano le dimensioni relative degli atomi.
Per gli elementi dei gruppi principali, i raggi atomici aumentano proce-
dendo dall’alto verso il basso lungo un gruppo e diminuiscono se ci si sposta da
sinistra a destra lungo un periodo. Le variazioni delle dimensioni atomiche pos-
sono essere spiegate tenendo conto dell’attrazione che il nucleo esercita sugli
elettroni e della repulsione reciproca che si verifica tra questi. Infatti, lungo un
gruppo, l’aumento del numero atomico comporta un incremento del numero
quantico principale, per cui gli elettroni esterni vengono a trovarsi ad una di-
H
H
2r
Figura 3.4
Distanza tra gli atomi e raggio atomico
dell’idrogeno nella molecola H
2
.
Li
155
Be
112
88
B
77
C
N
O
F
Ne
70
66
64
70
94
100
104
110
117
143
160
190
109
114
117
121
122
122
197
235
130
133
137
159
162
166
215
248
140
140
150
170
175
171
222
267
Na
Mg
Al
Si
P
S
Cl
Ar
K
Ca
Ga
Ge
As
Se
Br
Kr
Rb
Sr
In
Sn
Sb
Te
I
Xe
Cs
Ba
Tl
Pb
Bi
Po
At
Rn
H
37
He
50
I A
II A
III B
IV B
V B
VI B
VII B
0
Il raggio atomico aumenta
Figura 3.5
Raggi atomici di alcuni elementi, espressi in picometri (1 pm = 10
–12
m). Alcuni valori si riferiscono a raggi atomici covalenti nelle molecole X
2
. Si
tenga conto che atomi uguali in composti diversi mostrano valori diversi del raggio atomico.
















