
Capitolo
2
Lo stato solido e lo stato gassoso
47
www.
edises
.it
completamente indipendenti fra loro, ma per i nostri propositi questa sempli-
ficazione è ragionevole.
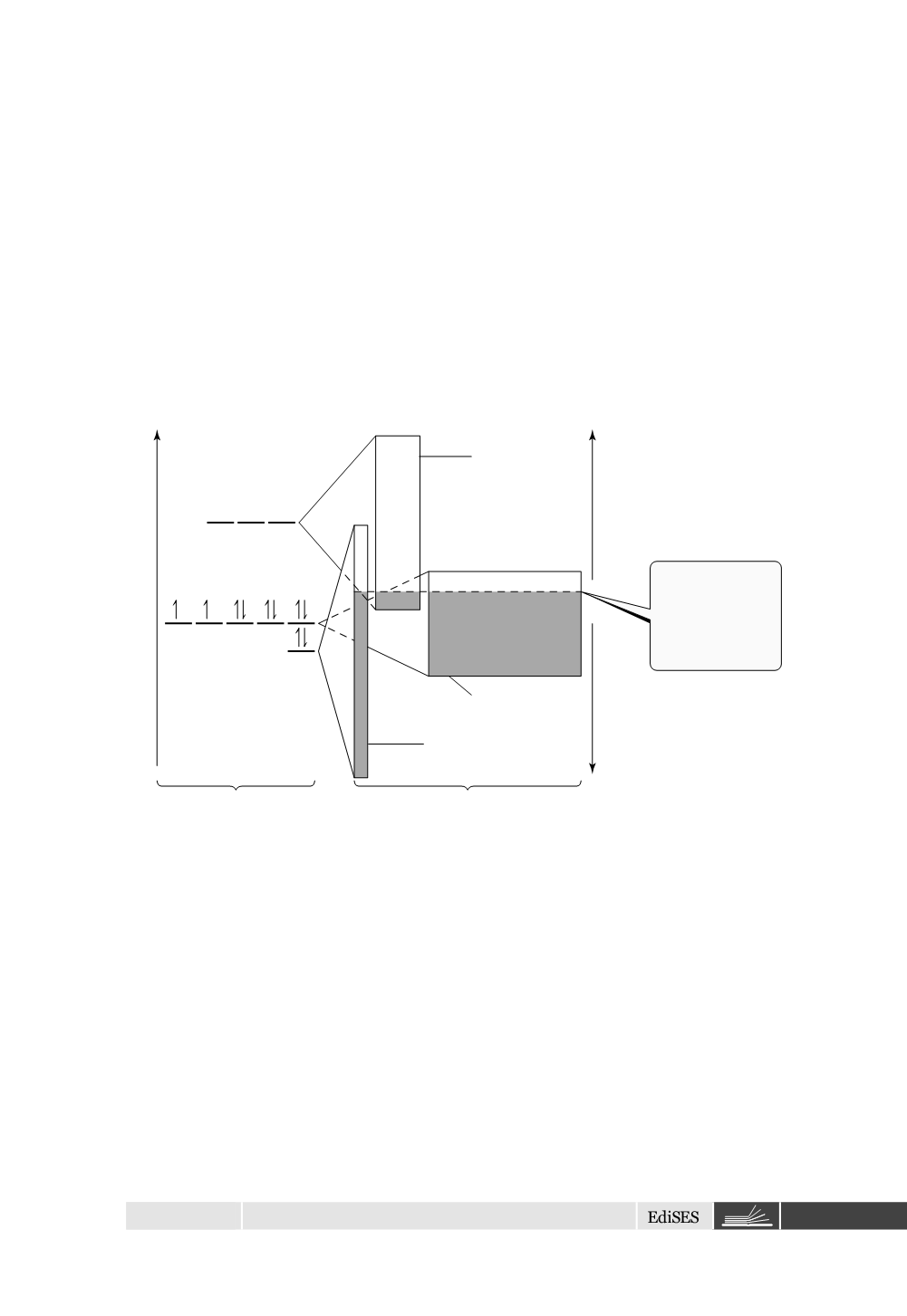
Le bande 4s, 4p, e 3d differiscono dalle altre nell’intervallo energetico che
esse abbracciano (rappresentato dalle altezze dei rettangoli sul lato destro del-
la Figura 2.8) e nel numero di elettroni che possono ospitare (rappresentato
dall’area dei rettangoli); le bande 4s, 4p e 3d possono ospitare 2, 6 e 10 elet-
troni per atomo, rispettivamente, due per orbitale, come dettato dal principio
di esclusione di Pauli. L’intervallo energetico abbracciato dalla banda 3d è più
piccolo dell’intervallo abbracciato dalle bande 4s e 4p in quanto gli orbitali 3d
sono più piccoli e perciò la sovrapposizione con gli orbitali sugli atomi vicini
è meno efficiente.
Energia
MO diventano
sempre più leganti
OM diventano
sempre più antileganti
Orbitali 3
d
Orbitali 4
p
Banda 4
p
(6e per atomo)
Banda 3
d
(10e per atomo)
Banda 4
s
(2e per atomo)
Struttura a bande
di un cristallo di nichel
MO pieni
Orbitali atomici di un singolo
atomo di nichel
Orbitali 4
s
0E PMRIE XVEXXIKKMEXE
WITEVE KPM SVFMXEPM
QSPIGSPEVM TMIRM
HEKPM SVFMXEPM
QSPIGSPEVM ZYSXM
Figura 2.8
La struttura elettronica a bande del nichel.
Molte proprietà dei metalli possono essere capite dalla Figura 2.8. Possiamo
pensare che le bande energetiche siano solo parzialmente riempite dagli elet-
troni. Il riempimento incompleto della banda energetica porta alle caratteristi-
che proprietà metalliche. Gli elettroni negli orbitali vicini alla parte superiore
dei livelli occupati richiedono molta poca energia per essere “promossi” agli
orbitali a più alta energia non occupati. Sotto l’influenza di una sorgente di
eccitazione, come ad esempio un potenziale elettrico o calore, gli elettroni si
muovono nei livelli non occupati e sono così liberi di muoversi nel reticolo,
determinando la conducibilità elettrica e termica.
Senza la sovrapposizione delle bande energetiche, le proprietà periodiche
dei metalli non potrebbero essere spiegate. In assenza delle bande d e p, ci
aspetteremmo che la banda s sia riempita per metà per i metalli alcalini e
















