
46
Scienze e tecnologie chimiche
000
www.
edises
.it
sono sempre i più antileganti. Inoltre, poiché ogni atomo di litio ha solo un
orbitale atomico nel guscio di valenza, il numero di orbitali molecolari è ugua-
le al numero di atomi di litio nella catena. Poiché ogni atomo di litio ha un
solo elettrone di valenza, la metà degli orbitali molecolari è totalmente occupa-
ta e l’altra metà è vuota, senza considerare la lunghezza della catena.
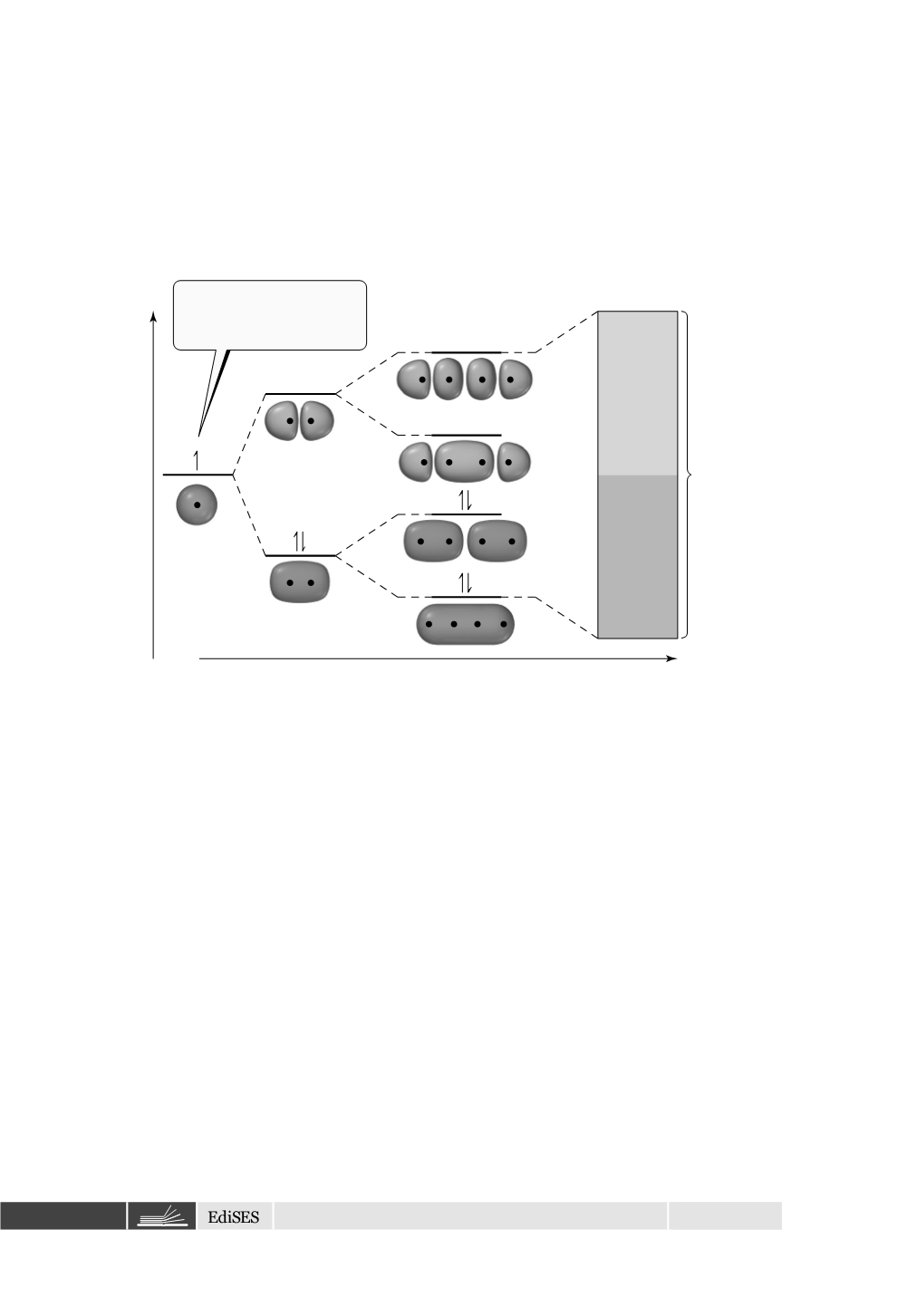
Energia
Banda di orbitali molecolari
Li
Li
2
Li
4
Li
I più
antileganti
I più
leganti
MO pieni
MO vuoti
Incremento del numero di atomi
- TYRXMRM VETTVIWIRXERS
M RYGPIM I PI JVIGGI EH EQS
VETTVIWIRXERS KPM IPIXXVSRM
Figura 2.7
I livelli di energia discreti nelle molecole singole diventano bande continue di
energia in un solido.
Se la catena diventa molto lunga, ci sono così tanti orbitali molecolari che
la separazione energetica tra di loro diventa sempre più piccola. Se la catena
diventasse di lunghezza infinita, gli stati energetici permessi diventerebbero
una
banda
continua.
Le strutture elettroniche di molti metalli sono più complicate di quelle
mostrate in Figura 2.7 poiché dobbiamo considerare più di un tipo di orbitale
atomico su ogni atomo. Poiché ogni tipo di orbitale può dar vita alla sua ban-
da, la struttura elettronica di un solido di solito consiste di una serie di bande.
La struttura elettronica di un solido viene chiamata
struttura
a
bande
.
La struttura a bande per un metallo tipico è mostrata schematicamente in
Figura 2.8. Il riempimento degli elettroni raffigurato corrisponde al metallo
nichel. La configurazione elettronica di un atomo di nichel è [Ar]3d
8
4s
2
, come
mostrato sul lato sinistro della figura. Le bande energetiche che si formano
da ciascuno di questi orbitali sono mostrate sulla destra. Gli orbitali 4s, 4p e
3d vengono trattati indipendentemente, ed ognuno dà luogo ad una banda
di orbitali molecolari. In pratica, queste bande di sovrapposizione non sono
















