
244
Scienze e tecnologie chimiche
000
www.
edises
.it
dove
a
è una costante di proporzionalità chiamata
assorbanza specifica
. Poiché
l’assorbanza è una grandezza adimensionale, l’assorbanza specifica deve avere
le unità che elidono le unità di
b
e
c
. Ad esempio, se le unità di
c
sono g L
–1
e
quelle di
b
i cm, allora l’assorbanza specifica ha unità di L · g
–1
cm
–1
.
Quando la concentrazione è espressa in moli per litro e
b
in centimetri, la
costante di proporzionalità viene chiamata
assorbanza specifica molare
ed ha
il simbolo speciale
e
. Così
A =
e
bc
dove
e
ha le unità di L mol
–1
cm
–1
. La legge di Beer si applica anche a soluzioni
contenenti più di una specie di sostanza assorbente. Se non vi è interazione
alcuna fra le varie specie, l’assorbanza totale per un sistema multicomponente
a singola lunghezza d’onda è pari alla somma delle assorbanze individuali.
Uno
spettro di assorbimento
è un grafico dell’assorbanza in funzione della
lunghezza d’onda. L’assorbanza potrebbe essere diagrammata anche in funzio-
ne del numero d’onda o della frequenza. La maggior parte dei moderni spet-
trofotometri a scansione produce direttamente uno spettro di assorbimento.
Assorbimento atomico
Quando un fascio di radiazione policromatica ultravioletta o visibile passa attra-
verso un mezzo contenente atomi gassosi, solo poche frequenze sono attenuate
dall’assorbimento. Quando lo spettro viene registrato con uno spettrometro ad
alta risoluzione, esso consiste di un numero di righe di assorbimento molto
strette.
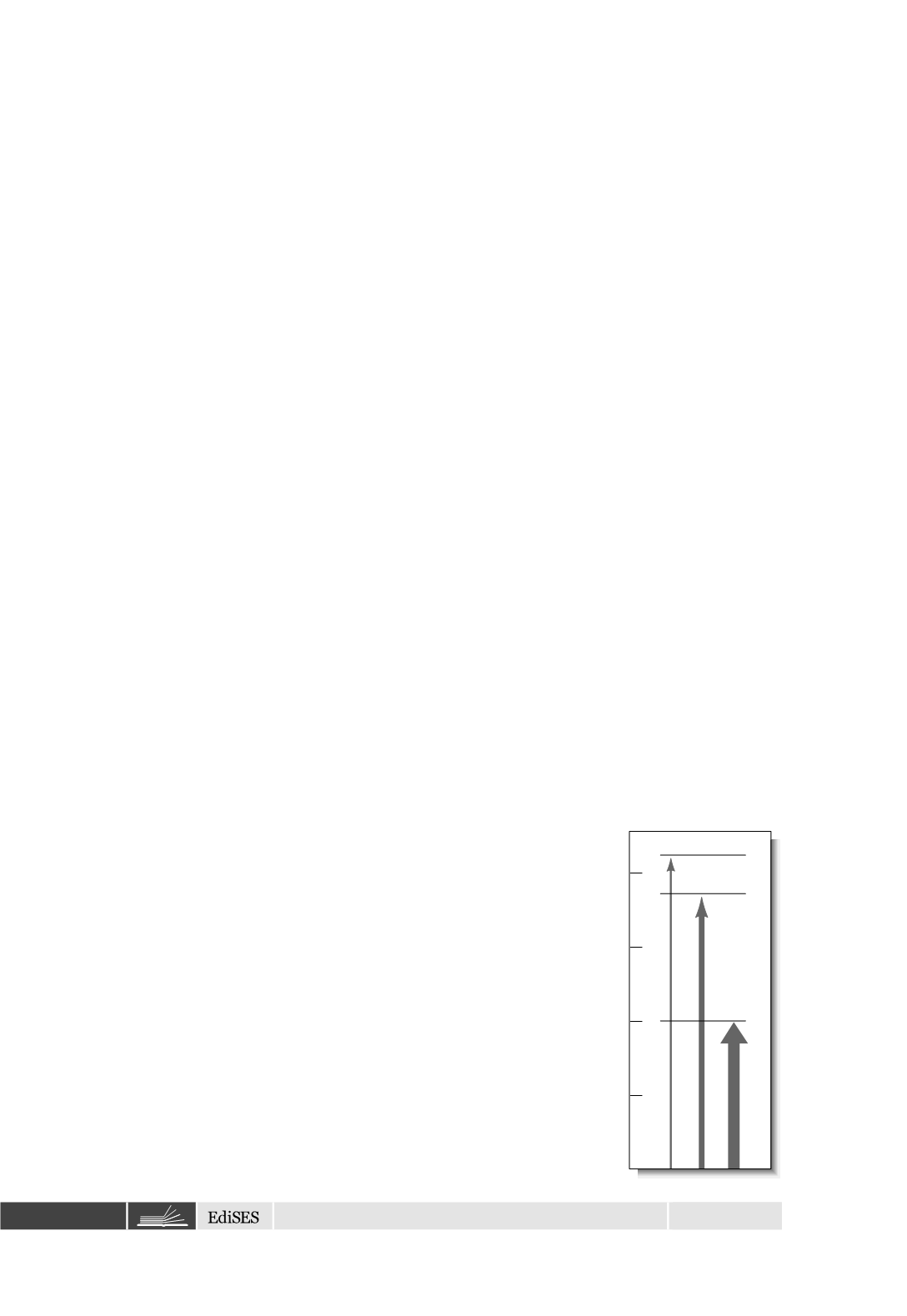
La Figura 15.1 è un diagramma parziale dei livelli energetici per il sodio che
mostra le principali transizioni di assorbimento atomico. Le transizioni, rappre-
sentate dalle frecce tra i livelli, coinvolgono l’eccitazione di un singolo elettro-
Figura 15.1
Diagramma parziale dei livelli energetici per il
sodio, che evidenzia le transizioni risultanti dall’assorbimen-
to a 590, 330 e 285 nm.
Energia, elettronvolt
0
1,0
285 nm
330 nm
590 nm
2,0
3,0
4,0
5
p
4
p
3
p
3
s
















